
| A.①③ | B.④⑤ | C.①② | D.②③ |


科目:高中化学 来源:不详 题型:单选题
| | 操作和现象 | 结论 |
| A | 向NaCl溶液中先滴加少量AgNO3溶液,后滴加少量NaI溶液,先有白色沉淀,后变成黄色沉淀 | 说明Ksp(AgI)<Ksp (AgCl) |
| B | 将SO2通入酸性KMnO4溶液中,紫色褪去 | 说明SO2具有漂白性 |
| C | 向FeCl3和CuCl2混合溶液中加入铁粉,有红色固体析出 | 说明氧化性:Cu2+>Fe3+ |
| D | 向某溶液中先滴加硝酸酸化,再滴加BaCl2溶液,有白色沉淀生成 | 该溶液中一定含有Ag+ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.SiO2既能溶于NaOH溶液又能溶于氢氟酸,说明SiO2是两性氧化物 |
| B.将Cu片置于浓H2SO4中,无明显现象,说明Cu在冷的浓硫酸中被钝化 |
| C.“雷雨发庄稼”的实质是自然固氮 |
| D.自来水厂可用明矾对水进行杀菌消毒 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.Fe在常温下可与浓硝酸、稀硝酸、浓硫酸剧烈反应 |
| B.Na久置于空气中,可以与空气中的有关物质发生反应,最终生成Na2CO3粉末 |
| C.Si、Cl2均能和烧碱溶液发生氧化还原反应,且都既做氧化剂又做还原剂 |
| D.因为碳酸、氨水能够导电,所以液氨、二氧化碳都为电解质 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
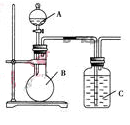
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
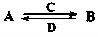 (在水溶液中进行)其中,C是溶于水显酸性的气体;D是淡黄色固体。写出C的结构式: ;D的电子式: 。
(在水溶液中进行)其中,C是溶于水显酸性的气体;D是淡黄色固体。写出C的结构式: ;D的电子式: 。查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| 选项 | 叙述I | 叙述II |
| A | NH4Cl加热有类似升华现象 | 用加热法除去NaCl中的NH4Cl |
| B | Fe的金属活动性大于Cu | 用FeCl3溶液可以腐蚀Cu |
| C | 水解程度:NaHCO3<Na2CO3 | 溶解度:Na2CO3>NaHCO3 |
| D | HNO3具有不稳定性 | 浓HNO3应保存在棕色试剂瓶中 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com