
NA��ʾ����٤��������ֵ������������ȷ���ǣ� ��
A�����³�ѹ�£�1mol NaHCO3������ϡ���ᷴӦ������������������22.4L
B��1mol NaBH4������ˮ��Ӧ��NaBH4+H2O��NaBO2+H2����δ��ƽ��ʱת�Ƶĵ�����Ϊ8NA
C��30g SiO2����������Ϊ0.5NA
D��0.06mol NaͶ��100mL 0.5mol/L ������Һ�У��������������Ϊ0.05 g
 ��ڽ��ȫ������ϵ�д�
��ڽ��ȫ������ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ��2015-2016ѧ�긣��ʡ�߶���ѧ�����в��Ի�ѧ�Ծ��������棩 ���ͣ�ѡ����
�۲����м���װ��ʾ��ͼ���й�������ȷ����
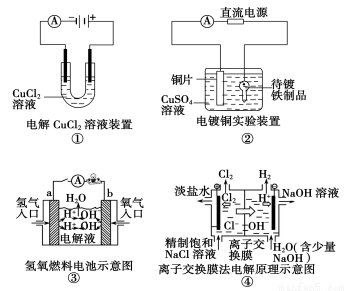
A��װ�â���������������ɫ����
B��װ�âڵĴ�������ƷӦ���Դ��������
C��װ�â������·������a������b��
D��װ�â��е����ӽ���Ĥ���������ӡ������ӡ�ˮ��������ͨ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2016�콭��ʡ�����и�����ѧ��10�½β⻯ѧ�Ծ��������棩 ���ͣ�ѡ����
ij�����������ֵ���ֱ�ӷ�Ӧ���ɣ��������NaHCO3��Һ��ͬʱ������ͳ������������л������з���������������
A��AlCl3 B��Na2O C��FeCl2 D��SiO2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2016�콭��ʡ�ϲ��и�����ѧ�ڵ��Ĵο��Ի�ѧ�Ծ��������棩 ���ͣ�ѡ����
�뼰�仯�������������ʮ�����ƣ����й����뼰�仯������ƶ���ȷ����
A��������ǿ�ᡢǿ����Һ������Ӧ B���������������ˮ
C���Ȼ�����Һ������ D��������Ļ�ѧʽBe2O3
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2016�콭��ʡ�ϲ��и�����ѧ�ڵ����ο��Ի�ѧ�Ծ��������棩 ���ͣ�ѡ����
������Һ�е�����һ���ܴ����������
A���ڼ��������ܲ�����������Һ�У�NH4+��Fe2����SO42����NO3��
B����������ˮ�������������Ũ��c(H��)��1��10��14mol/L����Һ�У�Ba2����NO3����K����ClO��
C����ʹ��̪���ɫ����Һ�У�Na����K����AlO2����CO32��
D����c(HCO3��)=0.1 mol��L-1����Һ�У�NH4+��AlO2����Cl����NO3��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2016�콭��ʡ�������ĴΣ�12�£��¿���ѧ�Ծ��������棩 ���ͣ�ѡ����
һ���¶��£������������Ϊ2.0 L�ĺ����ܱ������з������·�Ӧ��PCl5(g) PCl3(g)��Cl2(g)������˵����ȷ����
PCl3(g)��Cl2(g)������˵����ȷ����
��� | �¶ȣ��棩 | ��ʼ���ʵ�����mol�� | ƽ�����ʵ�����mol�� | �ﵽƽ������ʱ�䣨s�� | |
PCl5(g) | PCl3(g) | Cl2(g) | |||
�� | 320 | 0.40 | 0.10 | 0.10 | t1 |
�� | 320 | 0.80 | t2 | ||
�� | 410 | 0.40 | 0.15 | 0.15 | t3 |
A��ƽ�ⳣ��K��������>������
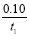 B����Ӧ����ƽ��ʱ��PCl5��ת���ʣ�������<������
B����Ӧ����ƽ��ʱ��PCl5��ת���ʣ�������<������
C����Ӧ����ƽ��ʱ������I�е�ƽ������Ϊv(PCl5)= mol/(L��s)
D����ʼʱ���������г���PCl5 0.30 mol��PCl3 0.45 mol��Cl2 0.10 mol����Ӧ�����淴Ӧ�������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2016�������������ʦ���и�����ѧ�����п��Ի�ѧ�Ծ��������棩 ���ͣ�ѡ����
��25�桢1.01��105Pa�£���22gCO2ͨ�뵽750mL1.0mol��L-1��NaOH��Һ�г�ַ�Ӧ���ų�x kJ�������ڸ�������1molCO2ͨ�뵽2L 1.0mol��L-1��NaOH��Һ�г�ַ�Ӧ���ų�ykJ��������CO2��NaOH��Ӧ����NaHCO3���Ȼ�ѧ��Ӧ����ʽΪ
A��CO2(g)+NaOH(aq)=NaHCO3(aq) ��H = -(2y-x)kJ��mol��1
B��CO2(g) + NaOH(aq) = NaHCO3(aq) ��H = -(4x-y)kJ��mol��1
C��CO2(g) + NaOH(aq) = NaHCO3(aq) ��H = -(2x-y)kJ��mol��1
D��CO2(g) + NaOH(aq) = NaHCO3(aq) ��H = -(8x-2y)kJ��mol��1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2016�츣��ʡ������ѧ�����п��Ի�ѧ�Ծ��������棩 ���ͣ�ѡ����
���и��������У��ڸ����������ܹ������������( )
A��ͨ������CO2�����Һ�У�Na+��SiO32����CH3COO����CO32��
B����ɫ��Һ�У�Mg2+��MnO4����SO42����K+
C��������Һ�п��ܴ�������Na+��ClO?��SO42����I?
D��c(H+)/c(OH��)=1012����Һ�У�NH4+��Al3+��NO3����Cl��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2015-2016�㽭����Чʵ��ѧ�߶������п��Ի�ѧ�Ծ����������棩 ���ͣ�ѡ����
�к͵ζ���������֪���ʵ���Ũ�ȵ��ᣨ�����ⶨδ֪���ʵ���Ũ�ȵļ���ᣩ������A�����ᣬ��B���������������ʽ������δ֪������ʵ���Ũ�ȵ��ǣ���Ϊ��ѧ��������
A��cB=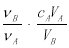
B��cB=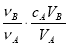
C��cB=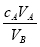
D��cB=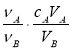
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com