
中和滴定是利用已知物质的量浓度的酸(或碱)来测定未知物质的量浓度的碱(或酸),若用A代表酸,用B代表碱,可以利用下式来计算未知碱的物质的量浓度的是(ν为化学计量数)
A.cB=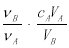
B.cB=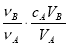
C.cB=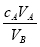
D.cB=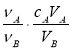
科目:高中化学 来源:2016届江西省高三上学期期中考试化学试卷(解析版) 题型:选择题
NA表示阿伏伽德罗常数的值,下列叙述正确的是( )
A.常温常压下,1mol NaHCO3与足量稀硫酸反应,生成气体的体积大于22.4L
B.1mol NaBH4与足量水反应(NaBH4+H2O→NaBO2+H2↑,未配平)时转移的电子数为8NA
C.30g SiO2所含分子数为0.5NA
D.0.06mol Na投入100mL 0.5mol/L 盐酸溶液中,产生气体的质量为0.05 g
查看答案和解析>>
科目:高中化学 来源:2016届浙江宁波效实中学高三上学期期中考试化学试卷(解析版) 题型:选择题
海洋中有丰富的食品、矿产、能源、药物和水产资源,下图为海水利用的部分过程。下列有关说法正确的是

A.用澄清的石灰水可鉴别NaHCO3和Na2CO3
B.溴元素在第③、⑤中被氧化,在第④中被还原
C.工业上一般用金属钠与无水MgCl2反应制取Mg单质
D.海水中还含有碘元素,只需将海水中的碘升华就可以得到碘单质
查看答案和解析>>
科目:高中化学 来源:2015-2016浙江宁波效实中学高一上期中考试化学试卷(解析版) 题型:填空题
实验室需要0.1 mol/L NaOH溶液450 mL和0.5 mol/L硫酸溶液500 mL。根据这两种溶液的配制情况回答下列问题:
(1)下列操作中,容量瓶具备的功能有_ _ 。
A.配制一定体积准确浓度的标准溶液
B.贮存溶液
C.测量容量瓶规格以下的任意体积的液体
D.用来加热溶解固体溶质
(2)根据计算用托盘天平称取NaOH的质量为__ ___g。在实验中其他操作均正确,若定容时仰视刻度线,则所得溶液浓度____ __0.1 mol/L(填“大于”、“等于”或“小于”,下同(。若NaOH溶液在转移至容量瓶时,洒落了少许,则所得溶液浓度____ __0.1 mol/L。
(3)根据计算得知,所需质量分数为98%、密度为1.84 g/cm3的浓硫酸的体积为___ _mL(计算结果保留一位小数。
查看答案和解析>>
科目:高中化学 来源:2015-2016浙江宁波效实中学高二上期中考试化学试卷卷(解析版) 题型:填空题
附加题
Ⅰ:如图所示,甲、乙之间的隔板K和活塞F都可左右移动,甲中充入2molA和1molB,乙中充入2molC和
1molHe,此时K停在0处。在一定条件下发生可逆反应:2A(g)+B(g) 2C(g); 反应达到平衡后,再恢复至原温度。回答下列问题:
2C(g); 反应达到平衡后,再恢复至原温度。回答下列问题:
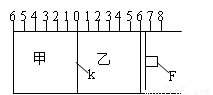
(1)达到平衡时,隔板K最终停留在0刻度左侧a处,则a的取值范围是 。
(2)若达到平衡时,隔板K最终停留在左侧刻度1处,此时甲容积为2L,反应化学平衡常数为____。
(3)若达到平衡时,隔板K最终停留在左侧刻度靠近0处, 则乙中可移动活塞F最终停留在右侧的刻度不大于 ;
Ⅱ:若一开始就将K、F固定,其它条件均不变,则达到平衡时:
(1)测得甲中A的转化率为b,则乙中C的转化率为 ;
(2)假设乙、甲两容器中的压强比用d表示,则d的取值范围是 。
查看答案和解析>>
科目:高中化学 来源:2015-2016宁夏回族自治银川一中高一上期中考试化学试卷(解析版) 题型:选择题
下列溶液中的Cl- 数目与25mL 0.1 mol·L-1的AlCl3溶液中Cl-数目相等的是
A.50mL 0.15mol·L-1的BaCl2溶液
B.50mL 0.3mol·L-1的NaCl溶液
C.25 mL0.3mol·L-1的FeCl3溶液
D.75 mL 0.1mol·L-1的KCl溶液
查看答案和解析>>
科目:高中化学 来源:2016届北京市朝阳区高三上学期期中统考化学试卷(解析版) 题型:选择题
根据20℃时某些物质的溶解度(g)数据:
CaCO3 | CaSO4 | Mg(OH)2 | MgCO3 |
1.4×10-3 | 2.55×10-2 | 9×10-4 | 1.1×10-2 |
下列说法不正确的是
A.硫酸钙悬浊液中存在CaSO4(s) Ca2+(aq)+ SO42-(aq)
Ca2+(aq)+ SO42-(aq)
B.用Na2CO3溶液浸泡锅炉中的水垢,可将水垢中的CaSO4转化为CaCO3
C.向Mg(OH)2悬浊液中滴加FeCl3,沉淀变为红褐色,说明溶解度Fe(OH)3< Mg(OH)2
D.向2ml饱和MgCl2 溶液中先后滴加0.1mol/L的Na2CO3、NaOH溶液各2滴,产生的白色沉淀为Mg(OH)2
查看答案和解析>>
科目:高中化学 来源:2016届山东省德州市高三上学期期中测试化学试卷(解析版) 题型:填空题
氧化还原反应是化学反应中的基本反应之一,研究氧化还原反应,对人类的进步 具有极其重要的意义。
I.某化学兴趣小组为探究Ag+和Fe3+氧化性,设计了如下实验:
第一步:将光亮的铁丝伸入AgNO3溶液中,一段时间后将铁丝取出。
第二步:为检验溶液中Fe的氧化产物,将溶液中的Ag+除尽后,进行了如下实验。可选用的试剂:KSCN溶液、酸性KMnO4溶液、氯水。请完成下表:
操 作 | 现象 | 结论 |
取少量除尽Ag+后的溶液于试管中,加人KSCN溶液,振荡 | (1) | 存在Fe3+ |
取少量除尽Ag+后的溶液于试管中,加入 (2) ,振荡 | (3) | 存在Fe2+ |
【实验结论】Fe的氧化产物为Fe2+和Fe3+,氧化性:Ag+ Fe3+(填“大于”或“小于”)。
Ⅱ.生物质混煤燃烧是当今能源燃烧利用的最佳方式之一,但生物质中氯含量较多,燃烧过程中会形成金属氯化物(如NaCl)和Cl2等物质,对金属炉壁造成腐蚀。
(1)NaCl和Cl2中化学键的类型分别是 和 。
(2)燃煤过程中生成的SO2会与NaCl等物质发生反应,生成硫酸盐和Cl2。若生成Cl2 22.4 L(标况)时转移电子数为4×6.02×1023,该反应的化学方程式是 。
Ⅲ.将32 g铜与l40 mL一定浓度的硝酸反应,铜完全溶解产生的NO和NO2混合气体在标准状况下的体积为11.2 L。请回答:
①待产生的气体全部释放后,向溶液加入V mL amol·L-1的NaOH溶液,恰好使溶液中的Cu2+全部转化成沉淀,则原硝酸溶液的浓度为 mol/L。(用含V、a的式子表示)
②欲使铜与硝酸反应生成的气体在NaOH溶液中全部转化为NaNO3,至少需要H2O2的质量为 g。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年四川省高二上学期11月月考化学试卷(解析版) 题型:选择题
下列说法正确的是
A.最外层电子排布为ns2的元素一定处于周期表IIA族
B.主族元素X、Y能形成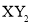 型化合物,则X与Y 的原子序数之差可能为2或5
型化合物,则X与Y 的原子序数之差可能为2或5
C.氯化氢的沸点比氟化氢的沸点高
D.同主族元素形成的氧化物的晶体类型均相同
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com