
氧化还原反应是化学反应中的基本反应之一,研究氧化还原反应,对人类的进步 具有极其重要的意义。
I.某化学兴趣小组为探究Ag+和Fe3+氧化性,设计了如下实验:
第一步:将光亮的铁丝伸入AgNO3溶液中,一段时间后将铁丝取出。
第二步:为检验溶液中Fe的氧化产物,将溶液中的Ag+除尽后,进行了如下实验。可选用的试剂:KSCN溶液、酸性KMnO4溶液、氯水。请完成下表:
操 作 | 现象 | 结论 |
取少量除尽Ag+后的溶液于试管中,加人KSCN溶液,振荡 | (1) | 存在Fe3+ |
取少量除尽Ag+后的溶液于试管中,加入 (2) ,振荡 | (3) | 存在Fe2+ |
【实验结论】Fe的氧化产物为Fe2+和Fe3+,氧化性:Ag+ Fe3+(填“大于”或“小于”)。
Ⅱ.生物质混煤燃烧是当今能源燃烧利用的最佳方式之一,但生物质中氯含量较多,燃烧过程中会形成金属氯化物(如NaCl)和Cl2等物质,对金属炉壁造成腐蚀。
(1)NaCl和Cl2中化学键的类型分别是 和 。
(2)燃煤过程中生成的SO2会与NaCl等物质发生反应,生成硫酸盐和Cl2。若生成Cl2 22.4 L(标况)时转移电子数为4×6.02×1023,该反应的化学方程式是 。
Ⅲ.将32 g铜与l40 mL一定浓度的硝酸反应,铜完全溶解产生的NO和NO2混合气体在标准状况下的体积为11.2 L。请回答:
①待产生的气体全部释放后,向溶液加入V mL amol·L-1的NaOH溶液,恰好使溶液中的Cu2+全部转化成沉淀,则原硝酸溶液的浓度为 mol/L。(用含V、a的式子表示)
②欲使铜与硝酸反应生成的气体在NaOH溶液中全部转化为NaNO3,至少需要H2O2的质量为 g。
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源:2016届福建省高三上学期期中考试化学试卷(解析版) 题型:选择题
下列各组离子中,在给定条件下能够大量共存的是( )
A.通入足量CO2后的溶液中:Na+、SiO32-、CH3COO-、CO32-
B.无色溶液中:Mg2+、MnO4-、SO42-、K+
C.酸性溶液中可能大量存在Na+、ClO?、SO42-、I?
D.c(H+)/c(OH-)=1012的溶液中:NH4+、Al3+、NO3-、Cl-
查看答案和解析>>
科目:高中化学 来源:2015-2016浙江宁波效实中学高二上期中考试化学试卷卷(解析版) 题型:选择题
中和滴定是利用已知物质的量浓度的酸(或碱)来测定未知物质的量浓度的碱(或酸),若用A代表酸,用B代表碱,可以利用下式来计算未知碱的物质的量浓度的是(ν为化学计量数)
A.cB=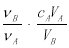
B.cB=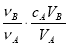
C.cB=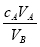
D.cB=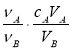
查看答案和解析>>
科目:高中化学 来源:2016届福建省、霞浦七中、周宁十中高三上期中联考化学试卷(解析版) 题型:选择题
过氧化氢在二氧化锰催化作用下分解放出氧气的反应机理如下:
①MnO2+H2O2+2H+===Mn2++O2↑+2H2O
②Mn2++H2O2===MnO2+2H+
下列说法正确的是
A.H2O2在①中是氧化剂,在②中是还原剂
B.Mn2+在①中是还原产物,在②中是氧化产物
C.在①中每生成1 mol O2,转移的电子数为2.408×1024
D.在二氧化锰催化作用下1 mol H2O2分解生成0.5 mol O2
查看答案和解析>>
科目:高中化学 来源:2016届内蒙古鄂尔多斯市西部四校高三上学期期中联考化学试卷(解析版) 题型:填空题
某学习小组为探究胶体的性质进行如下实验:
(1)取少量Fe2O3粉末(红棕色)加入适量盐酸,发生反应的化学方程式是:____________,反应后得到的溶液呈________色。
(2)取少量上述溶液置于试管中,滴入几滴NaOH溶液,可观察到有红褐色沉淀生成,反应的化学方程式为______________________。
(3)在小烧杯中加入20 mL 蒸馏水,加热至沸腾后,向沸水中滴入几滴饱和FeCl3溶液,继续煮沸至溶液呈__________色,即制得Fe(OH)3胶体。
(4)取上步实验烧杯中少量Fe(OH)3胶体置于试管中,向试管中滴加一定量的稀HI溶液,边滴加边振荡,会出现一系列变化。
①先出现红褐色沉淀,原因是________________________。
②随后沉淀溶解,溶液呈黄色,写出此反应的离子方程式:________________________。
③最后溶液颜色加深,原因是_____________________________。(用离子方程式表示)。
④用稀盐酸代替稀HI溶液,能出现上述哪些相同的变化现象?________(写序号)。
查看答案和解析>>
科目:高中化学 来源:2016届山东省青岛市高三上学期期中测试化学试卷(解析版) 题型:实验题
FeSO4·7H2O广泛用于医药和工业领域,实验室制备FeSO4·7H2O的流程如下:

(1)铁屑与稀硫酸反应前,应用10% Na2CO3溶液浸泡几分钟,操作目的是_________。
(2)最后得到的绿矾晶体用少量冰水洗涤,其目的:①除去晶体表面附着的硫酸等杂质;②_____________________。
(3)FeSO4·7H2O是某些补血剂的主要成分,将1.5 g某补血剂预处理,配成100mL溶液。实验室用KMnO4溶液通过氧化还原滴定测定该补血剂(1.5 g)中铁元素的含量,①配制100 mL 1.200 × 10 —2 mol·L—1的KMnO4溶液时,将溶解后的溶液转移至容量瓶中的操作方法是__________________________;
②实验中的KMnO4溶液需要酸化,可用于酸化的酸是_________________。
a. 稀硝酸 b.稀盐酸 c.稀硫酸 d.浓硝酸
KMnO4溶液应盛装在__________滴定管中。滴定到终点时的现象为____________。
③滴定完毕,三次实验记录KMnO4标准溶液的读数如下。
滴定次数实验数据 | 1 | 2 | 3 |
V(样品)/mL | 20.00 | 20.00 | 20.00 |
V(KMnO4)/mL(初读数) | 0.00 | 0.20 | 0.00 |
V(KMnO4)/mL(终读数) | 15.85 | 15.22 | 14.98 |
该补血剂中铁元素的质量分数为_____________________。
查看答案和解析>>
科目:高中化学 来源:2016届山东省烟台市高三上学期期中测试化学试卷(解析版) 题型:选择题
下列有关物质性质的说法错误的是
A.铁、铝在常温下都能被浓硫酸“钝化”
B.足量铝分别与含1molHCl、l mol NaOH的溶液反应,产生相同量的氢气
C.铁在纯氧中燃烧或高温下和水蒸气反应均能得到Fe3O4
D.浓硫酸与铜反应既体现了其强氧化性又体现了其酸性
查看答案和解析>>
科目:高中化学 来源:2016届山东省威海市乳山市高三上学期期中测试化学试卷(解析版) 题型:选择题
容器中发生一化学反应,反应过程中存在H2O、ClO-、CN-、HCO3-、N2、Cl-六种物质,在反应过程中测得ClO-和N2的物质的量随时间变化的曲线如图所示。下列有关判断中正确的是
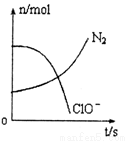
A.还原剂是含CN-的物质,氧化产物只有N2
B.氧化剂是ClO-,还原产物是HCO3-
C.氧化剂与还原剂的化学计量数之比为5:2
D.若生成2.24LN2,则转移电子必定为1mol
查看答案和解析>>
科目:高中化学 来源:2015-2016学年黑龙江哈尔滨附属中学高二上期中化学试卷(解析版) 题型:选择题
密闭的烧瓶里盛放气体A,在25℃时建立平衡:2A(g) B(g) ΔH<0,把烧瓶置于100℃的沸水中,在建立新平衡的过程中,烧瓶内混合气体的物理量始终不变的是
B(g) ΔH<0,把烧瓶置于100℃的沸水中,在建立新平衡的过程中,烧瓶内混合气体的物理量始终不变的是
A.平均相对分子质量 B.密度 C.容器内的压强 D.物质的量
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com