
【题目】PHBV(![]() )是一种可降解的高分子材料。此类产品可用于食品包装、化妆品、医药、卫生及农业等行业。它可由互为同系物的M、N(均为不饱和烃)等原料经下列路线合成:
)是一种可降解的高分子材料。此类产品可用于食品包装、化妆品、医药、卫生及农业等行业。它可由互为同系物的M、N(均为不饱和烃)等原料经下列路线合成:
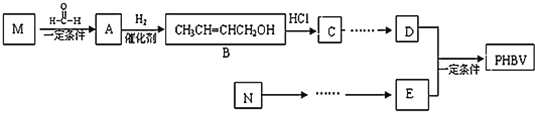
已知:RC≡CH+![]()
![]()
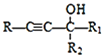
完成下列填空:
(1)写出N的结构简式______,C中官能团的名称______。
(2)写出反应类型:M→A______。B的同分异构体中能被新制氢氧化铜悬浊液氧化的有______种。
(3)由E和D合成PHBV的化学方程式是______。
(4)由乙醇制取乙酸的方法与过程可表述如下:C2H5OH![]() CH3CHO
CH3CHO![]() CH3COOH。请用上述表述方法表示由C合成D的方法与过程:______。
CH3COOH。请用上述表述方法表示由C合成D的方法与过程:______。
【答案】CH3CH2C≡CH 氯原子和羟基 加成反应 2 xCH3CH(OH)CH2COOH+yCH3CH2CH(OH)CH2COOH![]()
![]() +(x+y)H2O CH3CHClCH2CH2OH
+(x+y)H2O CH3CHClCH2CH2OH![]() CH3CH(Cl)CH2CHO
CH3CH(Cl)CH2CHO![]() CH3CHClCH2COOH
CH3CHClCH2COOH![]() CH3CH(OH)CH2COONa
CH3CH(OH)CH2COONa![]() CH3CH(OH)CH2COOH
CH3CH(OH)CH2COOH
【解析】
PHBV的结构简式为:![]() ,则其单体为:HOOCCH2CH(CH3)OH、HOOCCH2CH(CH2CH3)OH;M和甲醛反应生成A,A和氢气发生加成反应生成B,根据B的结构简式及题给信息知,则M的结构简式为:CH3C≡CH,A的结构简式为:CH3C≡CCH2OH,B和氯化氢发生加成反应生成C,C经过一系列反应后生成D,根据碳原子守恒知,D的结构简式为:HOOCCH2CH(CH3)OH,则E的结构简式为:HOOCCH2CH(CH2CH3)OH,N为CH3CH2C≡CH,据此来分析作答即可。
,则其单体为:HOOCCH2CH(CH3)OH、HOOCCH2CH(CH2CH3)OH;M和甲醛反应生成A,A和氢气发生加成反应生成B,根据B的结构简式及题给信息知,则M的结构简式为:CH3C≡CH,A的结构简式为:CH3C≡CCH2OH,B和氯化氢发生加成反应生成C,C经过一系列反应后生成D,根据碳原子守恒知,D的结构简式为:HOOCCH2CH(CH3)OH,则E的结构简式为:HOOCCH2CH(CH2CH3)OH,N为CH3CH2C≡CH,据此来分析作答即可。
(1)根据以上分析知,N的结构简式为:CH3CH2C≡CH,B和氯化氢发生加成反应生成C,则C中含有氯原子和羟基;
(2)M和甲醛发生加成反应生成A;B的同分异构体中能被新制氢氧化铜悬浊液氧化,说明含有醛基,符合条件的有:CH3CH2CH2CHO、(CH3)2CHCHO,所以有两种;
(3)D的结构简式为:HOOCCH2CH(CH3)OH,E的结构简式为:HOOCCH2CH(CH2CH3)OH,由E和D合成PHBV的化学方程式xCH3CH(OH)CH2COOH+yCH3CH2CH(OH)CH2COOH![]()
![]() +(x+y)H2O;
+(x+y)H2O;
(4)在加热、铜作催化剂条件下,3-氯-1-丁醇被氧气氧化生成3-氯丁醛,3-氯丁醛和新制氢氧化铜反应生成3-氯丁酸,3-氯丁酸和氢氧化钠的水溶液发生取代反应生成3-羟基丁酸钠,然后酸化得到3-羟基丁酸,所以其合成路线为:CH3CHClCH2CH2OH![]() CH3CH(Cl)CH2CHO
CH3CH(Cl)CH2CHO![]() CH3CHClCH2COOH
CH3CHClCH2COOH![]() CH3CH(OH)CH2COONa
CH3CH(OH)CH2COONa![]() CH3CH(OH)CH2COOH。
CH3CH(OH)CH2COOH。


 励耘书业暑假衔接宁波出版社系列答案
励耘书业暑假衔接宁波出版社系列答案科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.若H2O2分解产生1molO2,理论上转移的电子数约为4×6.02×1023
B.室温下,pH=3的CH3COOH溶液与pH=11的NaOH溶液等体积混合,溶液pH>7
C.钢铁水闸可用牺牲阳极或外加电流的阴极保护法防止其腐蚀
D.一定条件下反应N2+3H2![]() 2NH3达到平衡时,3v正(H2)=2v逆(NH3)
2NH3达到平衡时,3v正(H2)=2v逆(NH3)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】绿矾是含有一定量结晶水的硫酸亚铁,在工农业生产中具有重要的用途。某化学兴趣小组对绿矾的一些性质进行探究。回答下列问题:
(1)在试管中加入少量绿矾样品,加水溶解,滴加KSCN溶液,溶液颜色无明显变化。再向试管中通入空气,溶液逐渐变红。由此可知:______________、_______________。
(2)为测定绿矾中结晶水含量,将石英玻璃管(带端开关K1和K2)(设为装置A)称重,记为m1 g。将样品装入石英玻璃管中,再次将装置A称重,记为 m2 g。按下图连接好装置进行实验。

①仪器B的名称是____________________。
②将下列实验操作步骤正确排序___________________(填标号);重复上述操作步骤,直至A恒重,记为m3 g。
a.点燃酒精灯,加热 b.熄灭酒精灯 c.关闭K1和K2
d.打开K1和K2,缓缓通入N2 e.称量A f.冷却至室温
③根据实验记录,计算绿矾化学式中结晶水数目x=________________(列式表示)。若实验时按a、d次序操作,则使x__________(填“偏大”“偏小”或“无影响”)。
(3)为探究硫酸亚铁的分解产物,将(2)中已恒重的装置A接入下图所示的装置中,打开K1和K2,缓缓通入N2,加热。实验后反应管中残留固体为红色粉末。

①C、D中的溶液依次为_________(填标号)。C、D中有气泡冒出,并可观察到的现象分别为_______________。
a.品红 b.NaOH c.BaCl2 d.Ba(NO3)2 e.浓H2SO4
②写出硫酸亚铁高温分解反应的化学方程式_____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】T℃时在2L密闭容器中使X(g)与Y(g)发生反应生成Z(g)。反应过程中X、Y、Z的浓度变化如图1所示;若保持其他条件不变,温度分别为T1和T2时,Y的体积百分含量与时间的关系如图2所示.则下列结论不正确的是( )
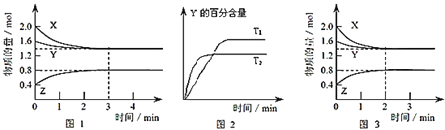
A.容器中发生的反应可表示为:3X(g)+Y(g)![]() 2Z(g)
2Z(g)
B.反应进行的前3min内,用X表示的反应速率v(X)=0.1molL-1min-1
C.保持其他条件不变,升高温度,反应的化学平衡常数K减小
D.若改变反应条件,使反应进程如图3所示,则改变的条件是加催化剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】5-氯-2,3-二氢-1-茚酮是合成新农药茚虫威的重要中间体。已知:R-Cl![]() RCH(COOC2H5)2
RCH(COOC2H5)2![]() RCH2COOH。以化合物A(分子式为C7H7Cl)为原料合成5-氯-2,3-二氢-1-茚酮(化合物F)工艺流程如下:
RCH2COOH。以化合物A(分子式为C7H7Cl)为原料合成5-氯-2,3-二氢-1-茚酮(化合物F)工艺流程如下:
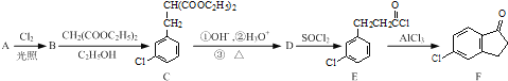
(1)写出反应A→B的化学方程式:______。
(2)化合物F中含氧官能团的名称为____,反应B→C的类型为______。
(3)某化合物是D的同分异构体,能使FeCl3溶液显紫色,且分子中只有3种不同化学环境的氢。写出该化合物的结构简式:______(任写一种)。
(4)E→F的转化中,会产生一种与F互为同分异构体的副产物,其结构简式为______。
(5)根据已有知识并结合相关信息,写出以化合物F和CH2(COOC2H5)2为有机反应原料制备![]() 的合成路线流程图(注明反应条件)______。合成路线流程图示例如下:CH3CH2OH
的合成路线流程图(注明反应条件)______。合成路线流程图示例如下:CH3CH2OH![]() CH2=CH2
CH2=CH2![]() Br-CH2-CH2-Br
Br-CH2-CH2-Br
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】炭粉与![]() 反应的产物比较复杂,某化学研究小组在实验室中以炭粉与
反应的产物比较复杂,某化学研究小组在实验室中以炭粉与![]() 反应为探究对象,拟通过实验探究反应后的产物,提出如下4种猜想:
反应为探究对象,拟通过实验探究反应后的产物,提出如下4种猜想:
猜想1:反应后产物是![]()
猜想2:反应后产物是![]() 和CO
和CO
猜想3:反应后产物是![]() 和
和![]()
猜想4:反应后产物是![]() 和
和![]()
(1)实验前,小组成员经过讨论认定猜想3不成立,理由是______。
(2)实验过程:已知:湿润的氯化钯试纸遇CO变黑,可用于检验是否有CO生成,针对猜想1、2、4,设计如图所示的实验装置:
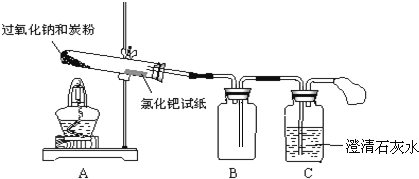
![]() 根据上图连接好实验装置,并检查气密性。
根据上图连接好实验装置,并检查气密性。
![]() 将
将![]() 炭粉与
炭粉与![]() 均匀混合装入试管,在靠近试管口处放置一张湿润的氯化钯试纸。
均匀混合装入试管,在靠近试管口处放置一张湿润的氯化钯试纸。
![]() 用酒精灯微微加热试管底部。
用酒精灯微微加热试管底部。
![]() 试管中发生剧烈反应并产生火花,氯化钯试纸未变黑,澄清石灰水未变浑浊。
试管中发生剧烈反应并产生火花,氯化钯试纸未变黑,澄清石灰水未变浑浊。
其中装置B的作用是______;由此可推测猜想______不成立。若CO在潮湿环境中可将氯化钯还原为黑色粉末状的钯![]() ,该反应的化学方程式为______。
,该反应的化学方程式为______。
(3)结果分析讨论:
试管冷却至室温、称量、测得剩余固体的质量为![]() ,由此可初步确认猜想______是正确的,炭粉与
,由此可初步确认猜想______是正确的,炭粉与![]() 反应的化学方程式为______。请你设计实验验证上述猜想4,完成下表中内容。
反应的化学方程式为______。请你设计实验验证上述猜想4,完成下表中内容。![]() 可供选择的药品有
可供选择的药品有![]() 溶液、酚酞溶液、盐酸等
溶液、酚酞溶液、盐酸等![]()
实验方案 | 预期实验结果和结论 |
____________ | ____________ |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】ClO2是一种高效安全的杀菌消毒剂。工业上可在较大电压下电解氯化钠先得到NaClO3再制备ClO2,其工艺原理示意图如图,下列说法正确的是( )
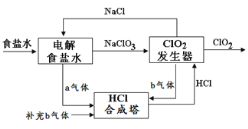
A.a气体是氯气,b气体是氢气
B.该装置中氯化钠电解槽阳极的电极方程式为:2Cl- - 2e- = Cl2↑
C.ClO2发生器中发生的反应:2ClO3- + 4H+ + 2Cl-=2ClO2↑ + Cl2↑ +2H2O
D.为使a、b气体恰好完全反应,理论上每生产1mol ClO2需要补充44.8L b气体(标准状况)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,在体积为10 L的固定容器中发生反应:N2(g)+3H2(g)![]() 2NH3(g) ΔH<0,反应过程如图,下列说法正确的是( )
2NH3(g) ΔH<0,反应过程如图,下列说法正确的是( )

A.t1 min时正、逆反应速率相等
B.X曲线表示NH3的物质的量随时间变化的关系
C.0~8min,H2的平均反应速率v(H2)=![]() mol·L-1·min-1
mol·L-1·min-1
D.10min,改变条件为升温
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮及其化合物在工业生产和国防建设中有广泛应用。回答下列问题:
(1)氮气性质稳定,可用作保护气。请用电子式表示氮气的形成过程:
。
(2)联氨(N2H4)是一种还原剂。已知:H2O(l)=H2O(g) △H=+44kJ/mol。试结合下表数据,写出N2H4 (g)燃烧热的热化学方程式: 。
化学键 | N—H | N—N | N=N | N≡N | O=O | O—H |
键能(kJ/mol) | 390.8 | 193 | 418 | 946 | 497.3 | 462.8 |
(3)KCN可用于溶解难溶金属卤化物。将AgI溶于KCN溶液中,形成稳定的Ag(CN)2—,该转化的离子方程式为: 。若已知Ksp(AgI)=1.5×10—16,K稳[Ag(CN)2—]=1.0×10-21,则上述转化方程式的平衡常数K= 。(提示:K稳越大,表示该化合物越稳定)
(4)氨的催化氧化用于工业生产硝酸。该反应可设计成新型电池,试写出碱性环境下,该电池的负极电极反应式: 。
(5)将某浓度的NO2气体充入一恒容绝热容器中,发生反应2NO2![]()
![]() N2O4其相关图像如下。
N2O4其相关图像如下。

①0~3s时v(NO2)增大的原因是 。
②5s时NO2转化率为 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com