
| A、标准状况下,5.6 L一氧化氮和5.6 L氧气混合后分子总数为0.5 NA |
| B、标准状况下,11.2 L水含有的电子总数为9 NA |
| C、7.1g氯气与足量的氢氧化钠溶液反应转移的电子数为0.1NA |
| D、1 mol C5H12(戊烷)中含有共价健17 NA |
| m |
| M |
| 5.6L |
| 22.4L/mol |
| m |
| M |
| 7.1g |
| 71g/mol |


 课堂全解字词句段篇章系列答案
课堂全解字词句段篇章系列答案 步步高口算题卡系列答案
步步高口算题卡系列答案 点睛新教材全能解读系列答案
点睛新教材全能解读系列答案科目:高中化学 来源: 题型:
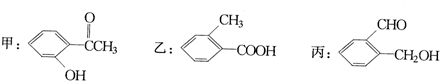
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、该反应的氧化剂只有Cu2O |
| B、Cu2S在反应中既是氧化剂,又是还原剂 |
| C、Cu既是氧化产物,又是还原产物 |
| D、每生成19.2g Cu,反应中转移0.6mol电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、胶体与其他分散系的本质区别在于分散质粒子的大小不同 |
| B、向沸水中加入几滴饱和FeCl3溶液煮沸至溶液呈红褐色,可得Fe(OH)3胶体 |
| C、当光束通过溶液时,可以看到一条光亮的“通路” |
| D、明矾作为净水剂的原因是形成氢氧化铝的胶体具有很强的吸附性 |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、
| ||
B、
| ||
C、
| ||
| D、无法确定 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、向含有0.1molNaOH溶液中通入3.36L(标准状况)CO2:2OH-+CO2=CO32-+H2O; |
| B、向100ml0.1mol?L-1 FeBr2溶液中通入0.025molCl2:2Fe2++4Br-+3Cl2=2Fe3++2Br2+6Cl-; |
| C、硫酸氢钠与足量的Ba(OH)2溶液反应:H++SO42-+Ba2++OH-=BaSO4↓+H2O; |
| D、碳酸氢镁溶液与足量的NaOH溶液反应:Mg2++2HCO3-+2OH-=MgCO3↓+CO32-+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、水的电离程度:甲>乙 |
| B、pH:甲<乙 |
| C、电离度:α2>α1 |
| D、甲溶液的c(H+)是乙溶液c(H+)的0.5α1倍 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com