
【题目】25℃时,部分物质的电离平衡常数如表所示:
化学式 | CH3COOH | H2CO3 | HClO |
电离平衡常数 | 10-5 | K1=4×10-7 K2=4×10-11 | 10-8 |
请回答下列问题:
(1)a.CH3COOH、b.H2CO3、c.HClO的酸性由强到弱的顺序为___。(填字母)
(2)物质的量浓度均为0.1mol/L的四种溶液:
a.CH3COONa b.Na2CO3 c.NaClO d.NaHCO3
pH由小到大排列的顺序是___(填字母)
(3)常温下0.1mol/LCH3COOH溶液加水稀释过程中,下列各项中数值变大的是___(填字母)
A.c(H+) B.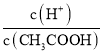 C.c(H+)·c(OH-)
C.c(H+)·c(OH-)
D.![]() E.
E.![]() F.
F.![]()
(4)25℃时,H2SO3![]() HSO3-+H+的电离常数Ka=1×10-2mol/L,则该温度下pH=3、c(HSO3-)=0.1mol/L的NaHSO3溶液中c(H2SO3)=___。
HSO3-+H+的电离常数Ka=1×10-2mol/L,则该温度下pH=3、c(HSO3-)=0.1mol/L的NaHSO3溶液中c(H2SO3)=___。
【答案】a>b>c a<d<c<b BD 0.01mol/L
【解析】
(1)酸的电离平衡常数越大,酸的酸性越强;
(2)酸的电离平衡常数越大,酸的酸性越强,其对应的酸根离子结合氢离子的能力越弱;
(3)加水稀释促进醋酸电离,醋酸电离增大程度小于溶液体积增大程度,所以溶液中c(H+)、c(CH3COOH)、c(CH3COO-)都减小,但是c(OH-)增大;
升高温度促进醋酸电离,溶液中c(H+)、c(CH3COO-)增大,c(CH3COOH)、c(OH-)减小;
(4)根据亚硫酸第一步电离平衡常数计算亚硫酸浓度。
(1)酸的电离平衡常数越大,酸的酸性越强,CH3COOH、H2CO3、HClO电离平衡常数依次减小,则酸性强弱顺序是CH3COOH>H2CO3>HClO,故答案为:a>b>c;
(2)酸的电离平衡常数越大,酸的酸性越强,其对应的酸根阴离子结合氢离子的能力越弱,酸性强弱顺序是CH3COOH>H2CO3>HClO>HCO3-,所以结合氢离子能力强弱顺序是CO32->ClO->HCO3->CH3COO-,结合氢离子的能力越强,溶液的碱性越强,pH越大,因此pH由小到大排列的顺序CH3COO-<HCO3-<ClO-<CO32-,即a<d<c<b,故答案为:a<d<c<b;
(3)加水稀释促进醋酸电离,但醋酸电离增大程度小于溶液体积增大程度,所以溶液中c(H+)、c(CH3COOH)、c(CH3COO-)都减小,但水的离子积常数不变,则c(OH-)增大。
A.加水稀释c(H+)减小,故A错误;B.加水稀释促进醋酸电离,n(H+)增大、n(CH3COOH)减小,所以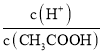 =
=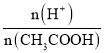 增大,故B正确;C.c(H+)c(OH-)=Kw,温度不变,水的离子积常数不变,故C错误;D.加水稀释,溶液中c(H+)减小,c(OH-)增大,则
增大,故B正确;C.c(H+)c(OH-)=Kw,温度不变,水的离子积常数不变,故C错误;D.加水稀释,溶液中c(H+)减小,c(OH-)增大,则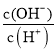 增大,故D正确;E.
增大,故D正确;E.![]() =Ka,温度不变,电离平衡常数不变,故E错误;F.
=Ka,温度不变,电离平衡常数不变,故E错误;F.![]() =
= ![]() =
=![]() ,温度不变,电离平衡常数和水的离子积常数不变,故F错误;故答案为:BD;
,温度不变,电离平衡常数和水的离子积常数不变,故F错误;故答案为:BD;
(4)电离常数Ka=1×10-2molL-1,则该温度下pH=3、c(HSO3-)=0.1molL-1的NaHSO3溶液中c(H2SO3)= 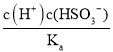 =
=![]() mol/L=0.01mol/L,故答案为:0.01mol/L。
mol/L=0.01mol/L,故答案为:0.01mol/L。


科目:高中化学 来源: 题型:
【题目】常温下,0.1mol·L-1的H2A溶液中各种微粒浓度的对数值(lgc)与pH的关系如图所示。
下列说法不正确的是
A. H2A是二元弱酸
B. HA-![]() H++A2-的电离平衡常数Ka=10-12
H++A2-的电离平衡常数Ka=10-12
C. 0.1mol·L-1的H2A溶液中:c(H+)=c(HA-)+2c(A2-)+c(OH-)
D. pH=4.2 时:c(HA-)=c(A2-)>c(H+)>c(H2A)>c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
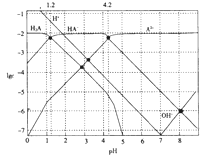
【题目】如图所示,a、b是石墨电极,通电一段时间后,b极附近溶液显红色。下列说法正确的是
A.X极是电源的负极,Y极是电源的正极
B.Cu电极上增重6.4 g时,b极产生4.48 L(标准状况)气体
C.电解过程中CuSO4溶液的pH逐渐增大
D.a极的电极反应式为2Cl--2e-=== Cl2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关说法不正确的是
A.![]() 可表示单核10电子粒子基态时的电子排布
可表示单核10电子粒子基态时的电子排布
B.电子仅在激发态跃迁到基态时才会产生原子光谱
C.同一原子能层越高,s电子云的半径越大
D.N、O、F电负性逐渐增大
查看答案和解析>>
科目:高中化学 来源: 题型:
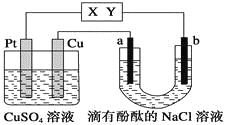
【题目】常温下,以酚酞溶液作指示剂,用0.1000mol·L-1NaOH溶液滴定20.00mL0.1000mol·L-1CH3COOH溶液所得滴定曲线如图:
(1)在整个实验过程中,不需要的仪器或用品是___(填序号)。
a.100mL容量瓶 b.锥形瓶 c.滴定管夹 d.漏斗 e.玻璃棒 f.滴定管
(2)到达滴定终点的标志是___。
(3)下列操作会导致测定结果偏高的是___。
A.碱式滴定管在装液前未用标准NaOH溶液润洗
B.滴定过程中,锥形瓶摇荡得太剧烈,锥形瓶内有液滴溅出
C.碱式滴定管尖嘴部分在滴定前没有气泡,滴定终点时发现气泡
D.达到滴定终点时,仰视读数
(4)如图点①所示溶液中c(CH3COO-)+c(OH-)___c(CH3COOH)+c(H+)(填“>”“<”或“=”,下同),点②所示溶液中:c(Na+)___c(CH3COOH)+c(CH3COO-)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于水的电离平衡的相关说法正确的是
A.c(H+)=![]() 的溶液一定呈中性
的溶液一定呈中性
B.将水加热,Kw增大,pH增大,呈碱性
C.向水中加入少量硫酸氢钠固体,溶液的c(H+)增大,平衡逆向移动,Kw减小
D.向0.1 mol·L-1醋酸溶液中加水,溶液中水电离产生的c(H+)将减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学生用0.200 0 mol·L-1的标准NaOH溶液滴定未知浓度的盐酸,其操作如下:
①用蒸馏水洗涤碱式滴定管,并立即注入NaOH溶液至“0”刻度线以上;
②固定好滴定管并使滴定管尖嘴处充满液体;
③调节液面至“0”或“0”刻度线以下,并记下读数;
④移取20.00 mL待测液注入洁净的还存有少量蒸馏水的锥形瓶中,并加入3滴酚酞溶液;
⑤用标准液滴定至终点,记下滴定管液面读数。
请回答下列问题:
(1)以上步骤有错误的是______(填编号)。
(2)若测定结果偏高,其原因可能是_____________(填字母)。
A.配制标准溶液的固体NaOH中混有KOH杂质
B.滴定终点读数时,仰视滴定管的刻度,其他操作正确
C.盛装待测液的锥形瓶用蒸馏水洗过后又用待测液润洗
D.滴定到终点读数时,发现滴定管尖嘴处悬挂一滴溶液
(3)判断滴定终点的现象是______________________。
(4)如图是某次滴定时的滴定管中的液面,其读数为________mL。
![]()
(5)根据下列数据,请计算待测盐酸的浓度:________mol·L-1。
滴定次数 | 待测体积(mL) | 标准烧碱溶液体积(mL) | |
滴定前读数 | 滴定后读数 | ||
第一次 | 20.00 | 0.40 | 20.40 |
第二次 | 20.00 | 2.00 | 24.10 |
第三次 | 20.00 | 4.00 | 24.00 |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铝的利用成为人们研究的热点,是新型电池研发中重要的材料。
(1)通过以下反应制备金属铝。
反应1:Al2O3(s)+AlCl3(g)+3C(s)===3AlCl(g)+3CO(g);ΔH1=akJ·mol-1
反应2:Al2O3(s)+3C(s)===2Al(l)+3CO(g);ΔH2=bkJ·mol-1
反应3:3AlCl(g)===2Al(l)+AlCl3(g);ΔH3
①反应3的ΔH3=_______kJ·mol-1。
②950℃时,铝土矿与足量的焦炭和Cl2反应可制得AlCl3。该反应的化学方程式是_______。
(2)在高温条件下进行反应:2Al(l)+AlCl3(g)![]() 3AlCl(g)。
3AlCl(g)。
①向图1所示的等容积A、B密闭容器中加入足量的Al粉,再分别充入1 mol AlCl3(g),在相同的高温下进行反应。图2表示A容器内的AlCl3(g)体积分数随时间的变化图,在图2中画出B容器内AlCl3(g)体积分数随时间的变化曲线。__________
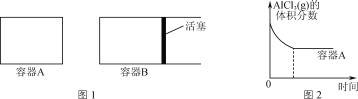
②1100℃时,向2 L密闭容器中通入3 mol AlCl(g),发生反应:3AlCl(g)=2Al(l)+AlCl3(g)。已知该温度下AlCl(g)的平衡转化率为80%,则该反应的平衡常数K=________。
③加入3molAlCl(g),在不同压强下发生反应,温度对产率的影响如图3所示。此反应选择温度为900℃的原因是_______________。
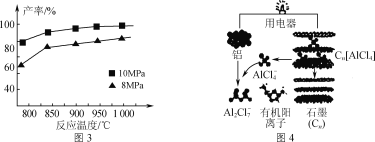
(3)用铝制作的快速放电铝离子二次电池的原理如图4所示。
①该电池充电时,阴极的电极反应式为_____。
②AlCl3和NaCl的熔融盐常用于镀铝电解池,电镀时AlCl4-和Al2Cl7-两种离子在电极上相互转化,其他离子不参与电极反应。NaCl的作用是_____。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com