
【题目】常温下,以酚酞溶液作指示剂,用0.1000mol·L-1NaOH溶液滴定20.00mL0.1000mol·L-1CH3COOH溶液所得滴定曲线如图:
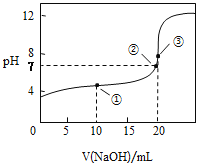
(1)在整个实验过程中,不需要的仪器或用品是___(填序号)。
a.100mL容量瓶 b.锥形瓶 c.滴定管夹 d.漏斗 e.玻璃棒 f.滴定管
(2)到达滴定终点的标志是___。
(3)下列操作会导致测定结果偏高的是___。
A.碱式滴定管在装液前未用标准NaOH溶液润洗
B.滴定过程中,锥形瓶摇荡得太剧烈,锥形瓶内有液滴溅出
C.碱式滴定管尖嘴部分在滴定前没有气泡,滴定终点时发现气泡
D.达到滴定终点时,仰视读数
(4)如图点①所示溶液中c(CH3COO-)+c(OH-)___c(CH3COOH)+c(H+)(填“>”“<”或“=”,下同),点②所示溶液中:c(Na+)___c(CH3COOH)+c(CH3COO-)。
【答案】ade 加入最后一滴氢氧化钠,溶液变为微红色,且30s内不褪色 AD > <
【解析】
以酚酞溶液作指示剂,用0.1000mol·L-1NaOH溶液滴定20.00mL0.1000mol·L-1CH3COOH溶液,结合实验过程和滴定过程中溶液性质的变化分析解答(1)和(2);
(3)根据c(待测)=![]() 分析不当操作对V(标准)的影响,以此判断浓度的误差;
分析不当操作对V(标准)的影响,以此判断浓度的误差;
(4)点①反应后溶质为等浓度的CH3COONa和CH3COOH,溶液呈酸性,说明CH3COOH电离程度大于CH3COO-的水解程度,则c(Na+)>c(CH3COOH),结合电荷守恒分析;点②的pH=7,则c(H+)=c(OH-),结合电荷守恒判断。
(1)以酚酞溶液作指示剂,用0.1000mol·L-1NaOH溶液滴定20.00mL0.1000mol·L-1CH3COOH溶液,实验过程中,20.00mL0.1000mol·L-1CH3COOH溶液放在锥形瓶中,0.1000mol·L-1NaOH溶液盛放在碱式滴定管中滴定,不需要的仪器或用品有:100mL容量瓶、漏斗、玻璃棒,故答案为:ade;
(2)以酚酞溶液作指示剂,用0.1000mol·L-1NaOH溶液滴定20.00mL0.1000mol·L-1CH3COOH溶液,当加入最后一滴氢氧化钠,溶液变为微红色,且30s内不褪色,说明达到了滴定终点,故答案为:加入最后一滴氢氧化钠,溶液变为微红色,且30s内不褪色;
(3)A.碱式滴定管在装液前未用标准NaOH溶液润洗,导致消耗标准液偏大,则测定结果偏高,故A选;B.滴定过程中,锥形瓶摇荡得太剧烈,锥形瓶内有液滴溅出,导致消耗标准液偏小,则测定结果偏低,故B不选;C.碱式滴定管尖嘴部分在滴定前没有气泡,滴定终点时发现气泡,导致消耗标准液偏小,则测定结果偏低,故C不选;D.达到滴定终点时,仰视读数,导致消耗标准液偏大,则测定结果偏高,故D选;故答案为:AD;
(4)点①反应后溶液是CH3COONa与CH3COOH物质的量之比为1∶1的混合物,根据图像,溶液显酸性,以CH3COOH的电离为主,则c(Na+)>c(CH3COOH),由电荷守恒可知:c(CH3COO-)+c(OH-)=c(Na+)+c(H+),则c(CH3COO-)+c(OH-)>c(CH3COOH)+c(H+),点②的pH=7,则c(H+)=c(OH-),由电荷守恒c(Na+)+c(H+)=c(CH3COO-)+c(OH-)可知:c(Na+)=c(CH3COO-),则c(Na+)<c(CH3COO-)+c(CH3COOH),故答案为:>;<。


 字词句篇与同步作文达标系列答案
字词句篇与同步作文达标系列答案科目:高中化学 来源: 题型:
【题目】25℃时,c(CH3COOH)+c(CH3COO-)=0.1mol·L-1的醋酸、醋酸钠混合溶液中,c(CH3COOH)、c(CH3COO-)与pH的关系如图所示。下列有关该溶液的叙述不正确的是( )
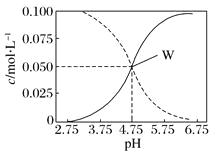
A. pH=5的溶液中:c(CH3COOH)>c(CH3COO-)>c(H+)>c(OH-)
B. 溶液中:c(H+)+c(Na+)=c(CH3COO-)+c(OH-)
C. 由W点可以求出25℃时CH3COOH的电离常数
D. pH=4的溶液中:c(H+)+c(Na+)+c(CH3COOH)-c(OH-)=0.1mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列是科研小组设计的一个氮氧化物原电池,两边的阴影部分为a,b惰性电极,分别用导线与烧杯的m,n(惰性电极)相连接,工作原理示意图如图:
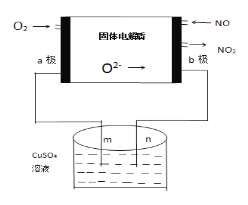
①a为___极,b极的电极反应式____________。
②在标准状况下,通入112mL的O2,可观察到烧杯中n处有_____生成,(假设烧杯中的溶液的体积为200mL,体积不变)最后反应终止时烧杯中溶液的pH为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金属(M)–空气电池(如图)具有原料易得、能量密度高等优点,有望成为新能源汽车和移动设备的电源。该类电池放电的总反应方程式为:4M+nO2+2nH2O=4M(OH) n。已知:电池的“理论比能量”指单位质量的电极材料理论上能释放出的最大电能。下列说法不正确的是
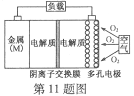
A. 采用多孔电极的目的是提高电极与电解质溶液的接触面积,并有利于氧气扩散至电极表面
B. 比较Mg、Al、Zn三种金属–空气电池,Al–空气电池的理论比能量最高
C. M–空气电池放电过程的正极反应式:4Mn++nO2+2nH2O+4ne–=4M(OH)n
D. 在M–空气电池中,为防止负极区沉积Mg(OH)2,宜采用中性电解质及阳离子交换膜
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,部分物质的电离平衡常数如表所示:
化学式 | CH3COOH | H2CO3 | HClO |
电离平衡常数 | 10-5 | K1=4×10-7 K2=4×10-11 | 10-8 |
请回答下列问题:
(1)a.CH3COOH、b.H2CO3、c.HClO的酸性由强到弱的顺序为___。(填字母)
(2)物质的量浓度均为0.1mol/L的四种溶液:
a.CH3COONa b.Na2CO3 c.NaClO d.NaHCO3
pH由小到大排列的顺序是___(填字母)
(3)常温下0.1mol/LCH3COOH溶液加水稀释过程中,下列各项中数值变大的是___(填字母)
A.c(H+) B.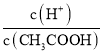 C.c(H+)·c(OH-)
C.c(H+)·c(OH-)
D.![]() E.
E.![]() F.
F.![]()
(4)25℃时,H2SO3![]() HSO3-+H+的电离常数Ka=1×10-2mol/L,则该温度下pH=3、c(HSO3-)=0.1mol/L的NaHSO3溶液中c(H2SO3)=___。
HSO3-+H+的电离常数Ka=1×10-2mol/L,则该温度下pH=3、c(HSO3-)=0.1mol/L的NaHSO3溶液中c(H2SO3)=___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国规定饮用水质量标准必须符合下表所示要求:
项目 | pH | Ca2+、Mg2+总浓度 | 细菌个数 |
相关值 | 6.5~8.5 | <0.0045mol·L-1 | <100个·mL-1 |
下图是源水处理成自来水的工艺流程示意图。
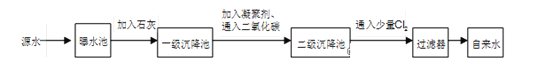
(1)源水中含Ca2+、Mg2+、HCO3-、Cl-等,加入石灰后生成Ca(OH)2,进而发生若干复分解反应,在一级沉降池中所得沉淀的主要成分为 _____ 和_______ (化学式)。
(2)FeSO4·7H2O是常用的凝聚剂,它在水中最终生成胶状Fe(OH)3沉淀。凝聚剂除去悬浮固体颗粒的过程______________(填写编号)。
①只是物理过程; ②只是化学过程; ③是物理和化学过程。
(3)Cl2的作用是______ ,这种作用是基于Cl2和水反应的产物具有 _______ 性。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】相同温度、相同浓度下的八种溶液,其pH由小到大的顺序如图所示,图中①②③④⑤代表的物质可能分别为
![]()
A. NH4Cl (NH4)2SO4 CH3COONa NaHCO3 NaOH
B. (NH4)2SO4 NH4Cl CH3COONa NaHCO3 NaOH
C. (NH4)2SO4 NH4Cl NaOH CH3COONa NaHCO3
D. CH3COOH NH4Cl (NH4)2SO4 NaHCO3 NaOH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可以充分说明反应P(g)+Q(g)![]() R(g)+S(g)在恒温下已达到平衡的是( )
R(g)+S(g)在恒温下已达到平衡的是( )
A. 反应容器内的压强不随时间改变
B. 反应容器内P、Q、R、S四者浓度之比为1:1:1:1
C. P的生成速率和S的生成速率相等
D. 反应容器内的气体总物质的量不随时间变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某气态烃含C 85.7%,含H 14.3%,在标准状况下的密度是2.5g/L.经红外光谱测定该烃分子中含一个双键.
(1)求该烃的实验式;
(2)求该烃的分子式;
(3)并写出它的各种同分异构体的结构简式及名称.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com