
【题目】25℃时,c(CH3COOH)+c(CH3COO-)=0.1mol·L-1的醋酸、醋酸钠混合溶液中,c(CH3COOH)、c(CH3COO-)与pH的关系如图所示。下列有关该溶液的叙述不正确的是( )
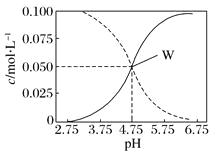
A. pH=5的溶液中:c(CH3COOH)>c(CH3COO-)>c(H+)>c(OH-)
B. 溶液中:c(H+)+c(Na+)=c(CH3COO-)+c(OH-)
C. 由W点可以求出25℃时CH3COOH的电离常数
D. pH=4的溶液中:c(H+)+c(Na+)+c(CH3COOH)-c(OH-)=0.1mol·L-1
【答案】A
【解析】
试题A.pH=5的溶液说明溶液显酸性,因此醋酸的电离程度大于醋酸根的水解程度,则溶液中
c(CH3COO-)>c(CH3COOH)>c(H+)>c(OH-),A错误;B.根据电荷守恒可知溶液中:c(H+)+c(Na+)=c(CH3COO-)+c(OH-),B正确;C.W点对应的醋酸和醋酸根的浓度洗涤,根据pH可以计算氢离子的浓度,则根据醋酸的电离平衡常数表达式![]() 可知,由W点可以求出25°C时CH3COOH的电离常数,C正确;D.pH=4的溶液中根据电荷守恒可知溶液中:c(H+)+c(Na+)=c(CH3COO-)+c(OH-)。又因为c(CH3COOH)+c(CH3COO-)=0.1 mol/L,则溶液中c(H+)+c(Na+)+c(CH3COOH)-c(OH-)=0.1 mol/L,D正确,答案选A。
可知,由W点可以求出25°C时CH3COOH的电离常数,C正确;D.pH=4的溶液中根据电荷守恒可知溶液中:c(H+)+c(Na+)=c(CH3COO-)+c(OH-)。又因为c(CH3COOH)+c(CH3COO-)=0.1 mol/L,则溶液中c(H+)+c(Na+)+c(CH3COOH)-c(OH-)=0.1 mol/L,D正确,答案选A。


科目:高中化学 来源: 题型:
【题目】2019年是元素周期表发表150周年,期间科学家为完善周期表做出了不懈努力。中国科学院院士张青莲教授曾主持测定了铟(49In)等9种元素相对原子质量的新值,被采用为国际新标准。铟与铷(37Rb)同周期。下列说法不正确的是
A. In是第五周期第ⅢA族元素
B. 11549In的中子数与电子数的差值为17
C. 原子半径:In>Al
D. 碱性:In(OH)3>RbOH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:p[c(HX)/c(X-)]=-lg[c(HX)/c(X-)]。室温下,向0. 10 mol/LHX溶液中滴加0.10 mol/L NaOH溶液,溶液pH随p[c(HX)/c(X-)]变化关系如图。下列说法不正确的是
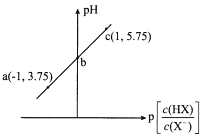
A. 溶液中水的电离程度:a<b<cB. 图中b点坐标为(0,4.75)
C. c点溶液中:c(Na+) =l0c(HX)D. 室温下HX的电离常数为10-4. 75
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】K2Cr2O7溶液中存在平衡:Cr2O72-(橙色)+H2O2CrO42-(黄色)+2H+。用K2Cr2O7溶液进行下列实验:
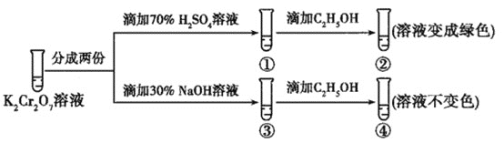
结合实验,下列说法不正确的是( )
A.①中溶液橙色加深,③中溶液变黄
B.②中Cr2O72-被C2H5OH还原
C.对比②和④可知K2Cr2O7酸性溶液氧化性强
D.若向④中加入70%H2SO4溶液至过量,溶液变为橙色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,0.1mol·L-1的H2A溶液中各种微粒浓度的对数值(lgc)与pH的关系如图所示。
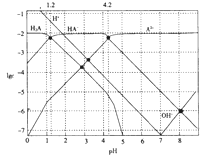
下列说法不正确的是
A. H2A是二元弱酸
B. HA-![]() H++A2-的电离平衡常数Ka=10-12
H++A2-的电离平衡常数Ka=10-12
C. 0.1mol·L-1的H2A溶液中:c(H+)=c(HA-)+2c(A2-)+c(OH-)
D. pH=4.2 时:c(HA-)=c(A2-)>c(H+)>c(H2A)>c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用“四室电渗析法”制备H3PO2的工作原理如图所示(已知:H3PO2是一种具有强还原性的一元弱酸;阳膜和阴膜分别只允许阳离子、阴离子通过),则下列说法不正确的是( )
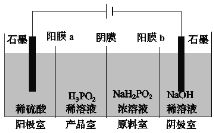
A. 阳极电极反应式为:2H2O-4e-===O2↑+4H+
B. 工作过程中H+由阳极室向产品室移动
C. 撤去阳极室与产品室之间的阳膜a,导致H3PO2的产率下降
D. 通电一段时间后,阴极室中NaOH溶液的浓度一定不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】三室式电渗析法处理含Na2SO4废水的原理如图所示,采用惰性电极,ab、cd均为离子交换膜,在直流电场的作用下,两膜中间的Na+和SO42-可通过离子交换膜,而两端隔室中离子被阻挡不能进入中间隔室。下列叙述正确的是

A. 通电后中间隔室的SO42-离子向正极迁移,正极区溶液pH增大
B. 该法在处理含Na2SO4废水时可以得到NaOH和H2SO4产品
C. 负极反应为2H2O–4e–=O2+4H+,负极区溶液pH降低
D. 当电路中通过1mol电子的电量时,会有0.5mol的O2生成
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】国内某科技研究小组首次提出一种新型的Li+电池体系,原理示意图如下。该体系正极采用含有I-、Li+的水溶液,负极采用固体有机聚合物,电解质溶液采用LiNO3溶液,聚合物阳离子交换膜作为隔膜将液态正极和固态负极分隔开(已知![]() 在水溶液中呈黄色)。下列有关判断正确的是
在水溶液中呈黄色)。下列有关判断正确的是
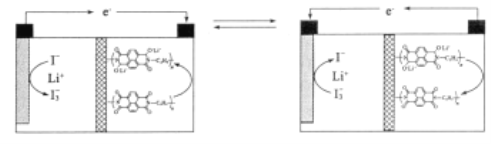
A. 左图是原电池工作原理图
B. 放电时,Li+从右向左通过聚合物离子交换膜
C. 放电时,正极区电解质溶液的颜色变深
D. 充电时,阴极的电极反应式为:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,以酚酞溶液作指示剂,用0.1000mol·L-1NaOH溶液滴定20.00mL0.1000mol·L-1CH3COOH溶液所得滴定曲线如图:
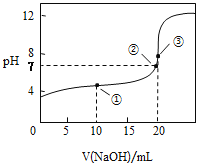
(1)在整个实验过程中,不需要的仪器或用品是___(填序号)。
a.100mL容量瓶 b.锥形瓶 c.滴定管夹 d.漏斗 e.玻璃棒 f.滴定管
(2)到达滴定终点的标志是___。
(3)下列操作会导致测定结果偏高的是___。
A.碱式滴定管在装液前未用标准NaOH溶液润洗
B.滴定过程中,锥形瓶摇荡得太剧烈,锥形瓶内有液滴溅出
C.碱式滴定管尖嘴部分在滴定前没有气泡,滴定终点时发现气泡
D.达到滴定终点时,仰视读数
(4)如图点①所示溶液中c(CH3COO-)+c(OH-)___c(CH3COOH)+c(H+)(填“>”“<”或“=”,下同),点②所示溶液中:c(Na+)___c(CH3COOH)+c(CH3COO-)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com