
【题目】如图是以铅蓄电池为电源,模拟氯碱工业电解饱和食盐水的装置图(C、D均为石墨电极)。电解一段时间后,若在电解池中C极一侧出来的气体无色无味,D极一侧出来的气体呈黄绿色有刺激性气味。请回答以下问题:

(1)已知铅蓄电池在放电时发生的反应:Pb+PbO2+4H++2SO42-=2PbSO4+2H2O,则A极的电极反应为___________________________;
(2)电解饱和食盐水的离子反应方程式是__________________;
(3)电极C的电极反应是_____________________________________________;
(4)电解时为防止两种气体产物混合,用阳离子交换膜做隔膜。则电解时Na+从______极区移向_____极区(填“C”或“D”);
(5)若电路上有0.2mol电子的电量通过,则铅蓄电池中消耗硫酸_________mol。
【答案】Pb+2e-+SO42-=PbSO4 2Cl-+2H2O![]() 2OH-+H2↑+Cl2↑ 2H2O+2e-=H2↑+2OH-或2H++2e-=H2↑ D C 0.2
2OH-+H2↑+Cl2↑ 2H2O+2e-=H2↑+2OH-或2H++2e-=H2↑ D C 0.2
【解析】
本题主要考查原电池与电解池串联相关知识。电解一段时间后,若在C极一侧出来的气体无色无味是氢气,D极一侧出来的气体呈黄绿色有刺激性气味是氯气,故D极是阳极,所以原电池中A极是负极,B极是正极,据此作答。
(1)A是负极,负极上铅失去电子和硫酸根离子结合生成硫酸铅,则电极反应式为:Pb+2e-+SO42-=PbSO4;
(2)电解氯化钠溶液时,C是阴极,阴极上得电子发生还原反应,电极反应式为2H2O+2e-===2OH-+ H2![]() ,D是阳极,阳极上氯离子失电子发生氧化反应,电极反应式为2Cl--2e-===Cl2
,D是阳极,阳极上氯离子失电子发生氧化反应,电极反应式为2Cl--2e-===Cl2![]() ,同时生成氢氧化钠,故电解饱和食盐水的离子反应方程式是:2Cl-+2H2O
,同时生成氢氧化钠,故电解饱和食盐水的离子反应方程式是:2Cl-+2H2O![]() 2OH-+H2↑+Cl2↑;
2OH-+H2↑+Cl2↑;
(3)根据以上分析可知,电极C的电极反应式为:2H2O+2e-===2OH-+ H2![]() 或2H++2e-=== H2
或2H++2e-=== H2![]() ;
;
(4)电解时阳离子向阴极移动,由此电解时Na+从D极区移向C极区;
(5)根据方程式Pb+PbO2+4H++2SO42-=2PbSO4+2H2O可知,当转移2mol电子时,消耗硫酸的物质的量为2mol,则转移0.2mol电子时,消耗硫酸的物质的量为0.2mol。


 期末冲刺100分创新金卷完全试卷系列答案
期末冲刺100分创新金卷完全试卷系列答案科目:高中化学 来源: 题型:
【题目】t℃时,在一个体积为2L密闭容器中加入反应物A、B,发生如下反应:A(s)+2B(g)![]() 3C(g)。反应过程中的部分数据如下表所示,下列说法正确的是
3C(g)。反应过程中的部分数据如下表所示,下列说法正确的是
物质 | 起始 | 2分钟 | 4分钟 | 6分钟 |
A | 2 mol | 1.2 mol | ||
B | 6 mol | 3.0 mol | ||
C | 0 mol | x mol | 4.5 mol |
A. 前2分钟内,A的反应速率为0.2molL-1min-1
B. 表中x的值为3.6
C. 4分钟时,反应达到平衡状态,此时正、逆反应的速率都为0
D. 升高温度,正、逆反应的速率都会增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E 代表五种元素。请填空:
(1)A 元素基态原子的最外层有 3 个未成对电子,次外层有 2 个电子,其元素符号为_____, 电子排布图为_____,原子核外电子的运动状态有_____种。
(2)B 元素的-2 价离子和 C 元素的+1 价离子的电子层结构都与氩原子的相同,B 的原子结构 示意图为_____,B、C 所形成的化合物的电子式为_____。
(3)D 元素的+3 价离子的 3d 能级为半充满状态,D 的元素名称为________,其基态原子的所有 电子占有________个原子轨道。
(4)E 元素基态原子的 M 层为全充满状态,N 层没有成对电子,只有一个未成对电子,则 E 的基态原子的电子有 ________________个 伸 展 方 向 ,其基态原子的电子排布式 为_________________________ ,E +的外围电子排布图为_____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于有机物结构、性质的说法正确的是
A. 石油的分馏、裂化和煤的干馏都是化学变化
B. 甲烷的一氯代物只有一种可证明甲烷分子呈正四面体形
C. 邻二甲苯只有一种结构,能证明苯环中不存在碳碳单键和碳碳双键交替的结构
D. 正丁烷和异丁烷的熔沸点相同,它们的一氯取代物都只有两种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2Zn(OH)2·ZnCO3是制备活性ZnO的中间体,以锌焙砂(主要成分为ZnO,含少量Cu2+、Mn2+等离子)为原料制备2Zn(OH)2·ZnCO3的工艺流程如下:下列说法不正确的是()

A. 当(NH4)2SO4,NH3·H2O的混合溶液呈中性时,c(NH4+) = 2c(SO42-)
B. “浸取”时为了提高锌的浸出率,可采取的措施是搅拌、适当加热
C. “浸取”时加入的NH3·H2O过量,生成MnO2的离子方程式为Mn2++H2O2+2NH3·H2O=MnO2+2NH4++2H2O
D. “过滤Ⅲ”所得滤液可循环使用,其主要成分的化学式是NH4HCO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是通过热化学循环在较低温度下由水或硫化氢分解制备氢气的反应系统原理,下列说法不正确的是

A. 反应②为反应③提供了原料
B. 反应②也是SO2资源利用的方法之一
C. 制得等量H2所需能量较少的是系统(I)
D. 系统(I)制氢的热化学方程式为H2O(l) ![]() H2(g) + 1/2O2(g) ΔH = +286 kJ/mol
H2(g) + 1/2O2(g) ΔH = +286 kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,1mol·L-l的某二元酸H2A溶液中,存在的HA-、A2-的物质的量分数随pH变化的关系如图所示,
下列说法不正确的是
A. H2A的电离方程式为:H2A==H++HA- HA-![]() A2-+H+
A2-+H+
B. 室温下,电离平衡HA-![]() A2-+H+的平衡常数Ka=10-3。
A2-+H+的平衡常数Ka=10-3。
C. 等物质的量浓度NaHA和Na2A溶液等体积混合,离子浓度大小关系为:c(Na+)>c(HA-)>c(A2-)
D. 在Na2A溶液中存在c(Na+)=2c(A2-)+2c(HA-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】E是一种能发生加聚反应的有机合成中间体,合成E的路线如下。

(1)反应①的类型是________________;反应②的试剂和条件是__________________。
(2)写出反应③的化学方程式_______________________________。
(3)D的结构简式___________。
D有多种同分异构体,写出一种符合下列要求的结构简式____________。
i. 含有苯环 ii. 能发生水解反应 iii. 苯环上的一溴代物有两种
(4)通过反应⑤得到E的产率不高,原因是___________________________。
(5)设计一条由CH3CH=CHCH3为原料制备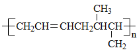 的合成路线。___________
的合成路线。___________
(合成路线常用的表示方法为:X![]() Y……
Y……![]() 目标产物)
目标产物)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com