
����Ŀ��2Zn(OH)2��ZnCO3���Ʊ�����ZnO���м��壬��п��ɰ(��Ҫ�ɷ�ΪZnO��������Cu2+��Mn2+������)Ϊԭ���Ʊ�2Zn(OH)2��ZnCO3�Ĺ����������£�����˵������ȷ����()

A. ��(NH4)2SO4��NH3��H2O�Ļ����Һ������ʱ��c(NH4+) = 2c(SO42-)
B. ����ȡ��ʱΪ�����п�Ľ����ʣ��ɲ�ȡ�Ĵ�ʩ�ǽ��衢�ʵ�����
C. ����ȡ��ʱ�����NH3��H2O����������MnO2�����ӷ���ʽΪMn2++H2O2+2NH3��H2O=MnO2+2NH4++2H2O
D. �����ˢ���������Һ��ѭ��ʹ�ã�����Ҫ�ɷֵĻ�ѧʽ��NH4HCO3
���𰸡�D
��������
�Ʊ�2Zn��OH��2ZnCO3����Ϊ��п��ɰ����Ҫ�ɷ�ΪZnO��������Cu2+��Mn2+�����ӣ��м�������李���ˮ��˫��ˮ��˫��ˮ�������������ɶ������̣����˺�����Һ�м���泥��ٹ��ˣ���ȥͭ���ӣ�������ȥ����İ���������̼����淋õ�2Zn��OH��2ZnCO3�Ͷ�����̼���壬���˵�2Zn��OH��2ZnCO3����ҺΪ�������Һ���ݴ˴��⡣
A.��NH4��2SO4��NH3H2O�Ļ����Һ�д��ڵ���غ㣺c ��NH4+��+c��H+��=2c��SO42-��+c��OH-����25��ʱ��pH=7�������Ե���Һ����c��H+��=c��OH-��������c��NH4+��=2c��SO42-������A��ȷ��
B.����Ӱ�췴Ӧ���ʵ������ж�����ȡ��ʱΪ�����п�Ľ����ʣ��ɲ�ȡ�Ĵ�ʩΪ���衢�ʵ����ȣ���B��ȷ��
C.����ȡ��ʱ�����NH3H2O��������Һ�ʼ��ԣ�˫��ˮ��������������MnO2����Ӧ�����ӷ���ʽΪMn2++H2O2+2NH3H2O=MnO2��+2NH4++2H2O����C��ȷ��
D.������3��������ҺΪ�������Һ����ѭ��ʹ�ã��仯ѧʽΪ��NH4��2SO4����D����
��ѡD��


 �����������Ů��ͯ������ϵ�д�
�����������Ů��ͯ������ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����Ҫ�����
��1���Ҵ�ͬ���칹��Ľṹ��ʽ__________����������Ҫ�ɷֵĻ�ѧʽ__________��
��2��������ˮ��Ӧ�����ӷ���ʽ____________________________________________��
��3����������������Һ��Ӧ�Ļ�ѧ����ʽ____________________________________��
��4��̼�����Ƶĵ��뷽��ʽ________________________________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��NH3 ��Ϊһ����Ҫ����ԭ����������Ӧ���ڹ�ҵ�����������й����ʷ�Ӧ�� �����о������������ 863 �ƻ���
(1)���������н�ǿ��ѡ��������רһ������֪����Ӧ I ��4NH3(g) +5O2(g)![]() 4NO(g) +6H2O(g)��H= 905.0 kJ��mol-1 ��Ӧ II : 4NH3(g)+3O2(g)
4NO(g) +6H2O(g)��H= 905.0 kJ��mol-1 ��Ӧ II : 4NH3(g)+3O2(g)![]() 2N2(g) +6H2O(g) ��H= 1266.6 kJ��mol-1 д�� NO �ֽ����� N2 �� O2 ���Ȼ�ѧ����ʽ_________��
2N2(g) +6H2O(g) ��H= 1266.6 kJ��mol-1 д�� NO �ֽ����� N2 �� O2 ���Ȼ�ѧ����ʽ_________��
(2)�ں��º���װ���г���һ������ NH3 �� O2,��ij�����������½��з�Ӧ I ,��ò�ͬʱ ��� NH3 �� O2,��Ũ�����±���
ʱ��(min) | 0 | 5 | 10 | 15 | 20 | 25 |
c(NH3)/mol��L1 | 1.00 | 0.36 | 0.12 | 0.08 | 0.072 | 0.072 |
c(O2)/mol L1 | 2.00 | 1.20 | 0.90 | 0.85 | 0.84 | 0.84 |
�������й���������ȷ����_____��
A��ʹ�ô���ʱ���ɽ��÷�Ӧ�Ļ�����ӿ��䷴Ӧ����
B������������� 4v ��(NH3) =6v ��(H2O)ʱ��˵����Ӧ�Ѵ�ƽ��
C����������n(NO)/n(NH3)=1 ʱ��˵����Ӧ�Ѵ�ƽ��
D��ǰ 10 �����ڵ�ƽ������ v( NO)=0.088 mol��L-1��min-1
(3)�Ʊ�����ʱ������һ���ķ�Һ����ҵ�ϳ�������������ͳ�ȥ��Һ�е� Cu2+�� ��֪��25��ʱ��K1(H2S) =1.3��107��K2(H2S) =7.1��1015��Ksp(CuS) =8.5��1045
���ڼ�����Һ�е�����Ũ��ʱ���漰����ĵ���ͨ��Ҫ���н��ƴ������� 0.lmol L1 ���� ��� pH��______(ȡ��������)��
��ijͬѧͨ�����Ƽ��㷢�� 0.lmol L1 �������� 0.0lmol L1 �������е� c(S2)��������� ����_____mol��L1
����֪��ij��Һ�ӽ������ԣ������������������ᣬ����Һ�� c(Cu2+) >_____mol��L1(���� ���������λ��Ч����)���ͻ���� CuS ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��﮿��������������Ϊ�綯������ʵ�ô����豸������ԭ��ʾ��ͼ���£�����������ȷ����
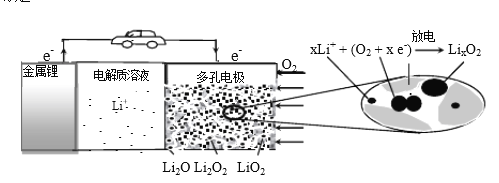
A. �õ�ع���ʱLi+���ƶ�
B. Li2SO4��Һ�����õ�ص������Һ
C. ��س��ʱ��Խ���������Li2O ����Խ��
D. ��ع���ʱ�������ɷ���: 2Li+ +O2+ 2e-=Li2O2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ����Ǧ����Ϊ��Դ��ģ���ȼҵ��ⱥ��ʳ��ˮ��װ��ͼ��C��D��Ϊʯī�缫�������һ��ʱ������ڵ�����C��һ�������������ɫ��ζ��D��һ�����������ʻ���ɫ�д̼�����ζ����ش��������⣺

��1����֪Ǧ�����ڷŵ�ʱ�����ķ�Ӧ��Pb+PbO2+4H++2SO42-=2PbSO4+2H2O����A���ĵ缫��ӦΪ___________________________��
��2����ⱥ��ʳ��ˮ�����ӷ�Ӧ����ʽ��__________________��
��3���缫C�ĵ缫��Ӧ��_____________________________________________��
��4�����ʱΪ��ֹ������������ϣ��������ӽ���Ĥ����Ĥ������ʱNa+��______��������_____�������C����D������
��5������·����0.2mol���ӵĵ���ͨ������Ǧ��������������_________mol��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ڲ�ͬ����²��A(g)��3B(g)![]() 2C(g)�� 2D(s)�����з�Ӧ���ʣ����з�Ӧ����������
2C(g)�� 2D(s)�����з�Ӧ���ʣ����з�Ӧ����������
A. ��(D)=0.01 molL-1s-1 B. ��(C)=0.010 molL-1s-1
C. ��(B)=0.6 molL-1min-1 D. ��(A)=0.2molL-1min-1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������⣩NH4Al(SO4)2��12H2O(�����)��������ĭ���������������ʯ����ɫ���ȡ�ij��ȤС��ͬѧ�������������ۡ�þ��������ص����������ȷ�Ӧ������Ҽ�����淋�Ϊԭ���Ʊ��������ʵ�飬�������£�
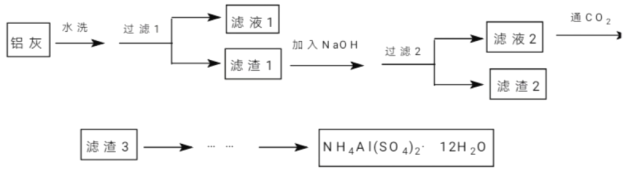
(1)�����й�˵������ȷ����_________��
A������Һ1���к���K+��Mg2+��Cl-
B��������1����������2���к�����ͬ������
C��������1��������������������ʵ��ʱ��
D��������Һ3�����ɲ����գ��ɵô���
(2)��NaOH�ܽ�������1��ʱ�����Բ���_________�ķ�ʽ��߽�����(д��3��)��
(3)������Һ2����ͨ��������CO2��д����Ӧ�����ӷ�Ӧ����ʽ__________________��
(4)��������3���Ʊ���������������²��裺a��g��_________��h(����������ȷ�����)
a���������ܽ� b������
c��������������
d�����½ᾧ
e��������������־�Ĥ
f�����Ʊ����������Һ
g������������Һת����������
h��ϴ�ӡ�����
(5)�ٸ��ݸ����ʵ��ܽ������(����ͼ)����80��ʱ����һ��Ũ�ȵ������ܽ�������3��ʱ�������˵�����Ũ��Ϊ_________��

A��3mol/L(1.20g/mL)
B��6mol/L(1.34g/mL)
C��9mol/L(1.49 g/mL)
D��18mol/L (1.84g/mL)
���������������ļ��ȷ��������__________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������к���þ�����Σ�2MgO��B2O3����þ�����Σ�2MgO��SiO2��������Al2O3��FeO�����ʡ��ɸ�����ʪ���Ʊ�����þ��������ᣨH3BO3�������һ�ֹ����������£�

��֪�������������������pH���������ӵ���ʼŨ��Ϊ0.1mol/L��
Fe(OH)3 | Al(OH)3 | Fe(OH)2 | Mg(OH)2 | |
��ʼ����ʱ | 1.9 | 3.4 | 7.0 | 9.1 |
��ȫ����ʱ | 3.2 | 4.7 | 9.0 | 11.1 |
��1�������������ܼӿ췴Ӧ���ʵĴ�ʩ��______��_______�ȡ�
��2�����ʱ������Ӧ��2MgO��SiO2 + 2H2SO4=2MgSO4 + SiO2 + 2H2O��2MgO��B2O3+ 2H2SO4 + H2O=2H3BO3 + 2MgSO4��
��������Ӧ���ֳ�����ǿ����H2SO4______H3BO3���������������
�� ���ʱ��������������Al2O3��FeOҲͬʱ�ܽ⣬д����ط�Ӧ�����ӷ���ʽ��______��______��
�� ��֪���������NaOH��Һ�������кͷ�ӦΪ��H3BO3 + OH- B(OH)4-�����й��������˵����ȷ����__������ţ���
a. ������һԪ��
b. ��NaHCO3�����еμӱ���������Һ�������ݲ���
c. ����ĵ��뷽��ʽ�ɱ�ʾΪ��H3BO3 + H2O![]() B(OH)4-+H+
B(OH)4-+H+
��3�������ɫ����Һ�е��������ӣ�ȡ��������Һ��______�������������֤����Һ�к���Fe2+��
��4����ȥ����Һ�е��������ӣ� ��MgO������Һ��pH��______���ϣ�ʹ��������ת��Ϊ______���ѧʽ�����������ˡ�
��5����ȡ���壺��.Ũ����Һ��ʹMgSO4��H3BO3�ӽ����ͣ���.�����¶�ʹ���־���ֱ����Һ�нᾧ�������ͼ�ܽ�����ߣ��������ķ�������Ũ��Һ���뵽��ѹ���У�______��������������������

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������ӷ���ʽ��ȷ����
A. KClO ������Һ�� Fe(OH)3 ��Ӧ��3ClO+2Fe(OH)3=2FeO42+3Cl+4H++H2O
B. ��ϡ�����ȥ��������Һ����������������ƣ�S2O32- +2H+= SO2��+S��+H2O
C. Ӳ֬�����Ҵ���������Ӧ��C17H35COOH+C2H518OH![]() C17H35COOC2H5+H218O
C17H35COOC2H5+H218O
D. ��̼�������Һ�м�������ʯ��ˮ��Ca2++HCO3-+OH-=CaCO3��+H2O
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com