
X、Y、Z、Q、R是五种短周期元素,原子序数依次增大。X、Y两元素最高正价与最低负价之和均为0;Q与X同主族;Z、R分别是地壳中含量最高的非金属元素和金属元素。
请回答下列问题:
(1)五种元素原子半径由大到小的顺序是(写元素符号) 。
(2)X与Y能形成多种化合物,其中既含极性键又含非极性键,且相对分子质量最小的物质(写分子式) 。
(3)由以上某些元素组成的化合物A、B、C、D有如下转化关系:A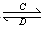 B (在水溶液中进行)
B (在水溶液中进行)
其中,C是溶于水显酸性的气体;D是淡黄色固体。写出C的结构式: ;D的电子式: 。
①如果A、B均由三种元素组成,B为两性不溶物,则A的化学式为 ;由A转化为B的离子方程式为 。
②如果A由三种元素组成,B由四种元素组成,A、B溶液均显碱性。用离子方程式表示A溶液显碱性的原因: 。A、B浓度均为0.1mol/L的混合溶液中,离子浓度由大到小的顺序是 ;常温下,在该溶液中滴加稀盐酸至中性时,溶质的主要成分有 。
(1)Na>Al>C>O>H;
(2)C2H2;
(3)O=C=O; 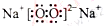 ;
;
①NaAlO2;AlO2-+2H2O+CO2="Al(OH)↓+" HCO3-(或2AlO2-+3H2O+CO2="2Al(OH)↓+" CO32-)
②CO32-+H2O  HCO3-+OH-(主);c(Na+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+);NaCl、NaHCO3、CO2(或H2CO3)
HCO3-+OH-(主);c(Na+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+);NaCl、NaHCO3、CO2(或H2CO3)
解析(1)据题目所述可以判断:X-H,Y-C,Z-O,Q-Al,R-Na,比较原子半径可知大到小顺序为:Na>Al>C>O>H;(2)CaHb是烃,种类繁多,同时含极性键和非极性键,且相对分子质量最小的是乙炔(C2H2),不要填成了 CH4,因为不合要求!
(3)五种元素中,水溶液能显酸性的气体只有CO2(O=C=O),淡黄色固体只有Na2O2(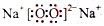 );①B是两性不溶性物质能与Na2O2反应,变为A,A又能与CO2反应变为B,结合五种元素不难判断B为Al(OH)3,A为NaAlO2,则A转化B的反应为(通入足量的CO2时的情况):AlO2-+2H2O+CO2="Al(OH)↓+" HCO3-(或2AlO2-+3H2O+CO2="2Al(OH)↓+" CO32-);②A含三种元素与CO2反应变为B含四种元素,且A、B均显碱性,并且B与Na2O2反应可得A,结合题给元素可判断:A是Na2CO3,B是NaHCO3,碳酸钠溶液显碱性由于CO32-的水解:CO32-+H2O
);①B是两性不溶性物质能与Na2O2反应,变为A,A又能与CO2反应变为B,结合五种元素不难判断B为Al(OH)3,A为NaAlO2,则A转化B的反应为(通入足量的CO2时的情况):AlO2-+2H2O+CO2="Al(OH)↓+" HCO3-(或2AlO2-+3H2O+CO2="2Al(OH)↓+" CO32-);②A含三种元素与CO2反应变为B含四种元素,且A、B均显碱性,并且B与Na2O2反应可得A,结合题给元素可判断:A是Na2CO3,B是NaHCO3,碳酸钠溶液显碱性由于CO32-的水解:CO32-+H2O  HCO3-+OH-(主要的,HCO3-再水解为次要,可以不用写出来);Na2CO3和NaHCO3两者如何混合没说清楚,只能当做等量混合,则混合后离子最多的是Na+,由于水解是微弱的,且CO32-水解程度大于HCO3-,故易排出此时溶中的离子浓度大小关系为:c(Na+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+);常温下由于反应生成的CO2未逸出完全,要使其呈中性,除了生成NaCl,必然还含有:CO2(酸性)与NaHCO3(碱性)一定比率。
HCO3-+OH-(主要的,HCO3-再水解为次要,可以不用写出来);Na2CO3和NaHCO3两者如何混合没说清楚,只能当做等量混合,则混合后离子最多的是Na+,由于水解是微弱的,且CO32-水解程度大于HCO3-,故易排出此时溶中的离子浓度大小关系为:c(Na+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+);常温下由于反应生成的CO2未逸出完全,要使其呈中性,除了生成NaCl,必然还含有:CO2(酸性)与NaHCO3(碱性)一定比率。
【方法指导】(1)原子半径大小比较时注意抓住“层、核”,电子层数越多半径越大,电子层数相同,核电荷数小,半径大,其他找到中间量,过渡比较;(2)仔细看清题意,不要浅尝辄止,如只看到相对分子质量最小,错写CH4,错写电子式与结构式、化学方程式、离子方程式等;(3)离子浓度大小比较抓住“两弱”、“三守恒”即:弱电解质的电离是微弱的、盐类水解一般是微弱的、电荷守恒、物料守恒、质子守恒。
【考点定位】以元素推断为背景,考查了:原子半径大小比较、电子式、结构式、元素及其化合物知识、水溶液中离子平衡等相关考点,综合性较好,比较有新意,值得推荐。


科目:高中化学 来源: 题型:
| C | D |


查看答案和解析>>
科目:高中化学 来源: 题型:
| A、X的原子半径比Z的小 | B、X与Z形成的化合物只有一种 | C、Y的简单氢化物的热稳定性比Z的强 | D、R的最高价氧化物的水化物碱性比Q的强 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、X与Y能形成多种化合物,其中既含极性键又含非极性键,其相对分子质量最小为16 | B、原子半径的顺序为:Q>R>Y>Z>X | C、X与Z、Q与Z 都可以形成原子个数比1:1和2:1的化合物 | D、化合物Q2Z2与QX,中阳离子与阴离子个数比均为1:1 |
查看答案和解析>>
科目:高中化学 来源:2013年全国普通高等学校招生统一考试理科综合能力测试化学(天津卷解析版) 题型:推断题
X、Y、Z、Q、R是五种短周期元素,原子序数依次增大。X、Y两元素最高正价与最低负价之和均为0;Q与X同主族;Z、R分别是地壳中含量最高的非金属元素和金属元素。
请回答下列问题:
(1)五种元素原子半径由大到小的顺序是(写元素符号) 。
(2)X与Y能形成多种化合物,其中既含极性键又含非极性键,且相对分子质量最小的物质(写分子式) 。
(3)由以上某些元素组成的化合物A、B、C、D有如下转化关系:A B (在水溶液中进行)
B (在水溶液中进行)
其中,C是溶于水显酸性的气体;D是淡黄色固体。写出C的结构式: ;D的电子式: 。
①如果A、B均由三种元素组成,B为两性不溶物,则A的化学式为 ;由A转化为B的离子方程式为 。
②如果A由三种元素组成,B由四种元素组成,A、B溶液均显碱性。用离子方程式表示A溶液显碱性的原因: 。A、B浓度均为0.1mol/L的混合溶液中,离子浓度由大到小的顺序是 ;常温下,在该溶液中滴加稀盐酸至中性时,溶质的主要成分有 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com