


 励耘书业暑假衔接宁波出版社系列答案
励耘书业暑假衔接宁波出版社系列答案科目:高中化学 来源: 题型:
| A、水玻璃可用于制备硅胶 |
| B、ClO-、I-、H+、Fe3+可以大量共存 |
| C、第一张元素周期表由道尔顿发现的 |
| D、NaOH溶液保存在带玻璃塞的试剂瓶中 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、混合气体的平均摩尔质量不变 |
| B、当容器中气体压强不变 |
| C、生成2mol Z的同时生成1mol X |
| D、混合气体的密度不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
 与甲醇燃料电池相比,乙醇燃料电池具有毒性低、理论能量密度高等优点,因此被广泛认为是更有前途的燃料电池.如图是一个乙醇燃料电池工作时的示意图.乙池中的两个电极均为石墨电极,乙池中盛有100mL 3.00mol/L的CuSO4溶液.请回答下列问题:
与甲醇燃料电池相比,乙醇燃料电池具有毒性低、理论能量密度高等优点,因此被广泛认为是更有前途的燃料电池.如图是一个乙醇燃料电池工作时的示意图.乙池中的两个电极均为石墨电极,乙池中盛有100mL 3.00mol/L的CuSO4溶液.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
 在2L密闭容器中,800℃时反应2NO(g)+O2(g)→2NO2(g)体系中,n(NO)随时间的变化如表:
在2L密闭容器中,800℃时反应2NO(g)+O2(g)→2NO2(g)体系中,n(NO)随时间的变化如表:| 时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
| n(NO)/mol | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
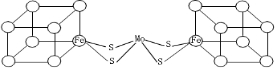 .图中左右两边对称,各含一个近似立方体的结构.每个立方体含有4个Fe原子和4个S原子,它们位于立方体的8个顶点,且原子间只有一种化学键.
.图中左右两边对称,各含一个近似立方体的结构.每个立方体含有4个Fe原子和4个S原子,它们位于立方体的8个顶点,且原子间只有一种化学键.查看答案和解析>>
科目:高中化学 来源: 题型:
| A、H2S、O2、N2 |
| B、HCl、Cl2、CO2 |
| C、N2、H2、CO |
| D、SO2、Cl2、O2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com