
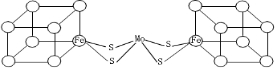
 .图中左右两边对称,各含一个近似立方体的结构.每个立方体含有4个Fe原子和4个S原子,它们位于立方体的8个顶点,且原子间只有一种化学键.
.图中左右两边对称,各含一个近似立方体的结构.每个立方体含有4个Fe原子和4个S原子,它们位于立方体的8个顶点,且原子间只有一种化学键.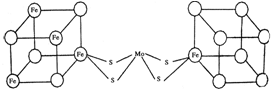 ;由信息可知,小正方体中4个铁原子应在互不相邻的顶点上,且这四个顶点连接构成正四面体,
;由信息可知,小正方体中4个铁原子应在互不相邻的顶点上,且这四个顶点连接构成正四面体, ;正四面体.
;正四面体.


 学而优暑期衔接南京大学出版社系列答案
学而优暑期衔接南京大学出版社系列答案 Happy holiday欢乐假期暑假作业广东人民出版社系列答案
Happy holiday欢乐假期暑假作业广东人民出版社系列答案科目:高中化学 来源: 题型:
| 编号 | 实验内容 | 试剂或操作 | 现象或结论 |
| A | 检验饼干中的淀粉 | KI溶液 | 饼干变蓝,含有淀粉 |
| B | 纤维素加硫酸水解后是否有葡萄糖 | 新制Cu(OH)2悬浊液加热 | 砖红色沉淀,有葡萄糖生成 |
| C | 鸡蛋清 | 浓硝酸 | 变黄色且有沉淀析出,发生了颜色反应并变性 |
| D | 油脂水解 | 加稀硫酸 | 油层消失,发生了皂化反应 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| A、氧化铝熔点很高,可制造用于熔融烧碱的坩埚 |
| B、炭具有还原性,一定条件下能将二氧化硅还原为硅 |
| C、铜的金属活动性比铁弱,可在海轮外壳上装若干铜块以减缓船体的腐蚀速率 |
| D、二氧化硫有漂白性,可以用于加工食品使食品增白 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com