
���ڹ�����ռ����Ҫ��λ��
��1����ҵ�ϳɰ�ʱ���ϳ�����ÿ����1 mol NH3���ų�46.1 kJ��������
�� ��ҵ�ϳɰ����Ȼ�ѧ����ʽ�� ��
�� ��֪��
N2 (g)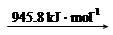 2N (g)
2N (g)
H2 (g)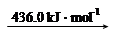 2H (g)
2H (g)
��Ͽ�1 mol N��H�������������_______kJ��
��2���±��ǵ���Ӧ���а�n(N2):n(H2)=1:3Ͷ�Ϻ���200�桢400�桢600���£���Ӧ�ﵽƽ��ʱ���������NH3�����ʵ���������ѹǿ�ı仯���ߡ�
�� ����a��Ӧ���¶��� ��
�� ���ڹ�ҵ�ϳɰ��ķ�Ӧ������������ȷ���� ������ĸ����
A. ��ʱ�����NH3�������H2��ƽ��ת����
B. �Ӵ����ܼӿ췴Ӧ���������H2��ƽ��ת����
C. ��ͼ��M��N��Q��ƽ�ⳣ��K�Ĵ�С��ϵ��K(M)=" K(Q)" >K(N)
�� M���Ӧ��H2ת������ �� ��3������һ��DZ�ڵ������Դ������������ȼ�ϵ�ص�ȼ�ϡ���ص��ܷ�ӦΪ��
��3������һ��DZ�ڵ������Դ������������ȼ�ϵ�ص�ȼ�ϡ���ص��ܷ�ӦΪ��
4NH3(g) + 3O2(g) = 2N2(g) + 6H2O(g)��
���ȼ�ϵ�صĸ�����Ӧʽ�� ��
��1����N2(g)+ 3H2(g)  2NH3(g)����H =" ��92.2" kJ��mol-1�� 391��2���� 200�棻�� AC���� 75%��3��2NH3��6e�� + 6OH��= N2 + 6H2O
2NH3(g)����H =" ��92.2" kJ��mol-1�� 391��2���� 200�棻�� AC���� 75%��3��2NH3��6e�� + 6OH��= N2 + 6H2O
���������������1���ٺϳ�����ÿ����1mol NH3���ų�46.1kJ�����������Ȼ�ѧ����ʽд������ע���ʾۼ�״̬�Ͷ�Ӧ��Ӧ�ų����������Ȼ�ѧ����ʽ��N2��g��+3H2��g�� 2NH3��g������H=-92.2kJ/mol���ڷ�Ӧ�ʱ�=��Ӧ����ѻ�ѧ�����յ�����-�������γɻ�ѧ���ų�������=3��436+945.8-6��N-H������=-92.2��N-H������=391kJ��2���ϳɰ���ӦΪ���ȷ�Ӧ����Ӧ�¶�Խ��Խ�����ڷ�Ӧ�Ľ��У�����a��NH3�����ʵ���������ߣ��䷴Ӧ�¶�Ӧ�����ͣ���aΪ200���A����ʱ�����NH3����ʹƽ�������ƶ�����A��ȷ��B�������ܼӿ췴Ӧ���ʣ������ܸı�ת���ʣ���B����Cƽ�ⳣ��K���¶��йأ������������أ�ͬһ�¶��µ�ƽ�ⳣ����ȣ��ϳɰ���ӦΪ���ȷ�Ӧ�����¶�Խ��ƽ�ⳣ��ԽС����C��ȷ��ѡAC������M��NH3�����ʵ���Ϊ60%��ʣ�����ʵ���Ϊ40%����n(N2):n(H2)=1:3Ͷ�ϣ���ʣ��H2���ʵ���Ϊ30%����ΪN2��g��+3H2��g��
2NH3��g������H=-92.2kJ/mol���ڷ�Ӧ�ʱ�=��Ӧ����ѻ�ѧ�����յ�����-�������γɻ�ѧ���ų�������=3��436+945.8-6��N-H������=-92.2��N-H������=391kJ��2���ϳɰ���ӦΪ���ȷ�Ӧ����Ӧ�¶�Խ��Խ�����ڷ�Ӧ�Ľ��У�����a��NH3�����ʵ���������ߣ��䷴Ӧ�¶�Ӧ�����ͣ���aΪ200���A����ʱ�����NH3����ʹƽ�������ƶ�����A��ȷ��B�������ܼӿ췴Ӧ���ʣ������ܸı�ת���ʣ���B����Cƽ�ⳣ��K���¶��йأ������������أ�ͬһ�¶��µ�ƽ�ⳣ����ȣ��ϳɰ���ӦΪ���ȷ�Ӧ�����¶�Խ��ƽ�ⳣ��ԽС����C��ȷ��ѡAC������M��NH3�����ʵ���Ϊ60%��ʣ�����ʵ���Ϊ40%����n(N2):n(H2)=1:3Ͷ�ϣ���ʣ��H2���ʵ���Ϊ30%����ΪN2��g��+3H2��g�� 2NH3��g������������Ӧ��H2���ʵ���Ϊ90%����M���Ӧ��H2ת������
2NH3��g������������Ӧ��H2���ʵ���Ϊ90%����M���Ӧ��H2ת������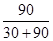 %=75%����3��ԭ����и���ʧȥ���ӣ����ϼ����ߣ�����������Ӧ����Ӧʽ2NH3��6e��+6OH��=N2+6H2O��
%=75%����3��ԭ����и���ʧȥ���ӣ����ϼ����ߣ�����������Ӧ����Ӧʽ2NH3��6e��+6OH��=N2+6H2O��
���㣺�Ȼ�ѧ����ʽ����ѧ�������ܵ��ת������ѧƽ�ⳣ�����㣻��ѧ��Դ���͵�أ�


 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
��ѧ��Ҫ�о���̼Ԫ�ؼ��仯������صĺܶ���⡣
��1����̿��������ȡˮú�������12g̼��ˮ������ȫ��Ӧ����ˮú��ʱ��������131. 6kJ�������÷�Ӧ���Ȼ�ѧ����ʽ��_________ ��
��2����ҵ�Ͽ��ý�̿ұ����������0.5mol̼��ȫ�������Ӧ���õ�0.6mol����ͬʱ����2�ֳ������壬��÷�Ӧ�Ļ�ѧ����ʽ��_________��
��3��̼��ˮ������ˮú���ķ�Ӧ��һ�����淴Ӧ��������������жϸ÷�Ӧһ���ﵽƽ��״̬����_________��ѡ���ţ�����
| A��V��(H2O)=V��(H2) |
| B���������¶Ȳ��ٷ����ı� |
| C������nmolH2ͬʱ����nmolCO |
| D������������������ʵ�������ʱ��ı� |
 CO(g)+H2(g)��ƽ�ⳣ������ֵΪ_________���ڵ�5����ʱ����ϵ���·����ߵ�T2�����ڵ�8����ʱ�ﵽ�µ�ƽ�⣬������ͼ�л�����5���ӵ�9���Ӻ�c(H2O)Ũ�ȱ仯���Ƶ����ߣ�ֻҪ���Ա�ʾ����
CO(g)+H2(g)��ƽ�ⳣ������ֵΪ_________���ڵ�5����ʱ����ϵ���·����ߵ�T2�����ڵ�8����ʱ�ﵽ�µ�ƽ�⣬������ͼ�л�����5���ӵ�9���Ӻ�c(H2O)Ũ�ȱ仯���Ƶ����ߣ�ֻҪ���Ա�ʾ����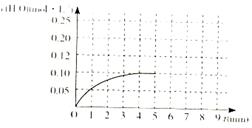
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
Ϊ��С����������CO2�Ի�����Ӱ�죬һ����������������������ŷ�������һ�����ѧ�Ҽ�ǿ�˶�CO2�������õ��о���
��1������п�ѧ���������ɫ���ɡ����룺�Ȱѿ������뱥��̼�����Һ��Ȼ���ٰ�CO2����Һ����ȡ������ʹ֮��Ϊ������ȼ�ϼ״�������ɫ���ɡ����뼼���������£�
д���ֽ���з�Ӧ�Ļ�ѧ����ʽ ���ںϳ����У�����4.4 kg CO2������H2
��ȫ��Ӧ���ɷų�����4947 kJ��д���ϳ����з�Ӧ���Ȼ�ѧ����ʽ ��
��2����CO2Ϊ̼�������Ʊ��Ҵ�����Ӧ���£�
2CO2(g) + 6H2(g)= CH3CH2OH(g) + 3H2O(g) ��H=��173.6kJ/mol
д����CH3OH(g)�ϳ�CH3CH2OH(g)�ķ�Ӧ���Ȼ�ѧ����ʽ ��
��3��ijʵ��С�����ݼ״�ȼ�յķ�Ӧԭ���������ͼ��ʾ�ĵ��װ�á�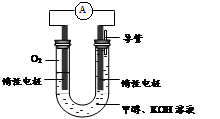
�ٸõ�������ĵ缫��ӦΪ ��
�ڹ���һ��ʱ������Һ��pH��С���õ���ܷ�Ӧ�Ļ�ѧ����ʽΪ ��������ת�� molʱ���μӷ�Ӧ�������������6.72L����״���£���
��4���Լ״�Ϊȼ�ϻ�����������ȼ�ϵ�أ���ص�����ͨ��O2������ͨ��״��������ڽ���������MO������ʣ��ɴ���O2�������õ�ظ��������ĵ缫��Ӧ�� ���ŵ�ʱ��O2�������ص� �����������������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
��1����101kPa�£�CH4(g)��H2(g)��C(s)��ȼ���ȷֱ�Ϊ890.3kJ?mo1��1��285.8kJ?mo1��1��393.5kJ?mo1��1����ӦC(s)+2H2(g)=CH4(g)�ķ�Ӧ�Ȧ�H= ��
��2����֪��2H2(g)+O2(g)=2H2O(g) ��H1
2H2(g)+O2(g)=2H2O(l) ��H2
2CO(g)+O2(g)=2CO2(g) ��H3
��Һ̬ˮת��Ϊ��̬ˮ���Ȼ�ѧ����ʽΪ ��
��CO��H2�ֱ�ȼ������CO2 (g)��H2O(g)�����õ���ͬ����������CO��H2��������� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�������������ǵĽ���ϢϢ��أ�Ŀǰ�ҹ�ͨ�����6����Ⱦ�������Ũ���������������ָ����AQI����SO2��NO2��CO������3���е���Ⱦ�
��1������3������ֱ��������������������������� ���ѧʽ����
��2��������������ʹ��Ǧ�ҷ��������ᣬ����Ҫ��ӦΪ��
SO2��g����NO2��g�� SO3��g����NO��g��
SO3��g����NO��g��
������֪2SO2��g����O2��g�� 2SO3��g�� ��H��a kJ��mol��1
2SO3��g�� ��H��a kJ��mol��1
2NO��g����O2��g�� 2NO2��g�� ��H��b kJ��mol��1
2NO2��g�� ��H��b kJ��mol��1
��SO2��g����NO2��g�� SO3��g����NO��g�� ��H�� kJ��mol��1��
SO3��g����NO��g�� ��H�� kJ��mol��1��
��һ���¶��£���̶����Ϊ2 L���ܱ������г���SO2��NO2��1 mol��������Ӧ��SO2��g����NO2��g�� SO3��g����NO��g����������ʵ�в���˵���÷�Ӧ�ﵽƽ��״̬���� ��ѡ����ţ���
SO3��g����NO��g����������ʵ�в���˵���÷�Ӧ�ﵽƽ��״̬���� ��ѡ����ţ���
a����ϵѹǿ���ֲ��� b������������ɫ���ֲ���
c��NO�����ʵ������ֲ��� d��ÿ����1 mol SO3��ͬʱ����1 mol NO2
�۲�â��з�Ӧ5 minĩ����ƽ�⣬��ʱ������NO��NO2�������Ϊ3�U1�������ʱ����SO2�ķ�Ӧ���ʦԣ�SO2���� ���˷�Ӧ�ڸ��¶��µ�ƽ�ⳣ��K�� ��
��3���״�������Ϊ��Ҫ���л�ȼ�ϣ�ͨ������CO��H2�ϳɼ״����䷴Ӧ�Ļ�ѧ����ʽΪCO��g����2H2��g�� CH3OH��g��������һ�ݻ��ɱ���ܱ������У�����10 mol CO��20 mol H2�����ںϳɼ״���CO��ƽ��ת���ʣ��������¶ȣ�T����ѹǿ��P���Ĺ�ϵ��ͼ��ʾ��
CH3OH��g��������һ�ݻ��ɱ���ܱ������У�����10 mol CO��20 mol H2�����ںϳɼ״���CO��ƽ��ת���ʣ��������¶ȣ�T����ѹǿ��P���Ĺ�ϵ��ͼ��ʾ��
�������ϳɼ״��ķ�ӦΪ ��Ӧ������ȡ������ȡ�����
��A��B��C�����ƽ�ⳣ��KA��KB��KC�Ĵ�С��ϵΪ ��
�������ﵽƽ��״̬Aʱ���ɵļ״����ڹ��ɼ״�һ����ȼ�ϵ�أ��������ҺΪKOHŨ��Һ����õ�ع���ʱ�����ĵ缫��ӦʽΪ ��������ͨ�����·�ĵ������Ϊ mol��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
����������CO2���ڻ��ۣ���в����̬����������������ܵ�ȫ�����ע��
��1����ҵ�ϳ��ø�Ũ�ȵ�K2CO3��Һ����CO2������ҺX�������õ�ⷨʹK2CO3��Һ��������װ��ʾ��ͼ���£�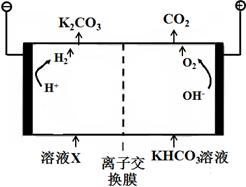
�������������ķ�Ӧ���� ��H ++ HCO3-=H2O+CO2����
����CO32-��������������ԭ�� ��
��2������װ���в�����CO2��H2��һ�������·�Ӧ���ɼ״��Ȳ����ҵ�����ø÷�Ӧ�ϳɼ״���
��֪��25 �棬101 KPa�£�
H2(g)+1/2 O2(g)=H2O(g) �� H1=" -242" kJ/mol
CH3OH(g)+3/2 O2(g)=CO2 (g)+2 H2O(g) �� H2=" -676" kJ/mol
д��CO2��H2������̬�״��Ȳ�����Ȼ�ѧ����ʽ ��
�����ʾ�ϳɼ״��ķ�Ӧ�������仯ʾ��ͼ��������ȷ���� ������ĸ��ţ���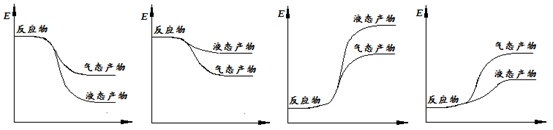
a b c d
��3������ȼ�ϵ����һ���������ォ��ѧ��ֱ��ת���ɵ��ܵ�װ�á���֪ij�ּ״�
����ȼ�ϵ���У��������ҺΪ���ԣ�ʾ��ͼ���£�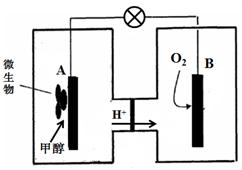
�õ�����·���ӵ���������Ϊ ����д����A��B����B��A������
����������B�缫����Һ��pH�빤��ǰ��Ƚ� ����д����������С�����䡱����Һ����仯���Բ��ƣ���
A�缫�����״������ĵ缫��ӦʽΪ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�����ѣ�CH3OCH3������ɫ���壬����Ϊһ��������Դ���ɺϳ��������ΪH2��CO��������CO2��ֱ���Ʊ������ѣ�������Ҫ���̰��������ĸ���Ӧ����Ϊ���淴Ӧ����
��CO(g)+ 2H2(g) = CH3OH(g) ��H1=��90��1 kJ��mol-1
��CO2(g)+ 3H2(g) = CH3OH(g)+H2O(g) ��H2=��49��0 kJ��mol-1
ˮú���任��Ӧ��CO(g) + H2O (g)=CO2(g)+H2(g) ��H3=��41��1 kJ��mol-1
�����Ѻϳɷ�Ӧ��2CH3OH(g)=CH3OCH3(g)+H2O(g) ��H4=��24��5 kJ��mol-1
��1����H2��COֱ���Ʊ������ѣ���һ����Ϊˮ���������Ȼ�ѧ����ʽΪ ��
��2��һ���¶��£��ں����ܱ������н��з�Ӧ�٣�����������˵����Ӧ����ƽ��״̬���� ��
a.����������ƽ����Է����������ֲ���
b.�����������ܶȱ��ֲ���
c.CH3OH(g)Ũ�ȱ��ֲ���
d.CH3OH(g)���������ʵ���H2 (g)����������
��3��һ���¶��£���8mol CH3OH(g)����5L�ܱ������н��з�Ӧ�ܣ�һ��ʱ���ƽ��״̬����Ӧ�����й��ų�49kJ��������CH3OH(g)��ƽ��ת����Ϊ �����¶��£�ƽ�ⳣ��K= �����¶��£����������ٳ���2mol CH3OH(g)�����ٴδﵽ��ƽ��״̬���ж���ȷ���� ��
a.CH3OH(g)��ƽ��ת���ʼ�С
b.CH3OCH3 (g)�������������
c.H2O(g)Ũ��Ϊ0��5mol��L-1
d.�����е�ѹǿ��Ϊԭ����1��25��
��4�������ѡ�����ȼ�ϵ�ؾ��������죬Ч�ʸߵ��ŵ㣬�������ܶȸ��ڼ״�ȼ�ϵ�أ��������Ϊ���ԣ������ѡ�����ȼ�ϵ�صĸ�����ӦΪ ������2��8L(��״��)����ʱ���������������·�ĵ��� mol
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
���������ھ�������������ˮ������������ҵ�������ΪƯ����
��1���������������������ҿ������������е��ʷ�Ӧ���磺
6Ag(s)+O3(g)= 3Ag2O(s)�� ��H=��236kJ��mol-1��
��֪��2Ag2O(s)= 4Ag(s)+O2(g)�� ��H=" +62" kJ��mol-1��
��O3ת��ΪO2���Ȼ�ѧ����ʽΪ________________________________________________��
��2��������ˮ���ֽ⣬������Ũ�ȼ���һ�������ʱ�����±���ʾ��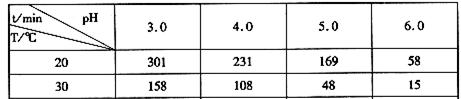
���ϱ���֪pH�����ܼ���O3�ֽ⣬������O3�ֽ�������õ���__________(��������)��
��3����ⷨ�������������г���Ũ�ȸߡ��ɷִ�������ˮ���ܽ�ȸߵ����ƣ���ҽ�ơ�ʳƷ�ӹ�����ֳҵ����ͥ������й㷺Ӧ��ǰ������ѧ��P��Tatapudi��������ʹ�������������µ��ˮ�ķ����Ƶó�����
������������Χ��ˮ�в�������缫��ӦʽΪ_______________________���������������������ɹ������⣬��缫��ӦʽΪ_______________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
��1�� 8gҺ̬��CH3OH����������ȫȼ�գ����ɶ�����̼�����Һ̬ˮʱ�ͷų�Q kJ����������д��Һ̬CH3OHȼ���ȵ��Ȼ�ѧ����ʽ ��
��2���ڻ�ѧ��Ӧ�����У��ƻ��ɻ�ѧ����Ҫ�����������γ��»�ѧ���ֻ��ͷ�������
| ��ѧ�� | H��H | N��H | N��N |
| ����/kJ·mol��1 | 436 | 391 | 945 |
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com