
【题目】铁是人类应用较早, 当前应用量最大的金属元素,下列有关铁及其化合物的有关说法中不正确的是( )
A.磁铁矿的主要成分是Fe3O4
B.铁与水蒸气在高温下的反应产物为Fe3O4和H2
C.除去FeCl2溶液中的FeCl3杂质可以向溶液中加入足量铁粉后过滤
D.Fe3与KSCN 溶液产生红色沉淀
科目:高中化学 来源: 题型:
【题目】根据下列实验操作和现象能得到相应结论的是
选项 | 实验操作和现象 | 结 论 |
A | 向苯酚钠溶液中通入足量CO2溶液变浑浊 | 酸性:H2CO3>C6H5OH>HCO3- |
B | 向KBrO3溶液中通入少量Cl2然后再加入少量苯,有机层呈橙红色 | 氧化性:Cl2>Br2 |
C | 将等浓度等体积的KI溶液和FeCl3溶液混合,充分反应后滴入KSCN溶液,溶液变红 | 溶液中存在平衡: 2Fe3++2I- |
D | 向2支均盛有2mL相同浓度银氨溶液的试管中,分别滴入2滴相同浓度的KCl、KI溶液,前者无明显现象,后者有黄色沉淀 | Ksp(Agl)>Ksp(AgCl) |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以NA代表阿伏加德罗常数,则关于热化学方程式C2H2(g)+![]() O2 (g)→2CO2 (g)+H2O(l) △H =-1300kJ/mol 的说法中,正确的是( )
O2 (g)→2CO2 (g)+H2O(l) △H =-1300kJ/mol 的说法中,正确的是( )
A.当1 NA个水分子生成且为液体时,吸收1300kJ的能量
B.当10 NA个电子转移时,该反应放出1300kJ的能量
C.当2 NA个碳氧共用电子对生成时,放出1300kJ的能量
D.当4 NA个碳氧共用电子对生成时,放出1300kJ的能量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在温度T1和T2时,分别将0.5molCH4和1.2molNO2充入体积为1L的密闭容器中,发生反应: CH4(g)+2NO2(g)![]() N2(g)+CO2(g)+2H2O(g),测得有关数据如表:
N2(g)+CO2(g)+2H2O(g),测得有关数据如表:
时间/min | 0 | 10 | 20 | 40 | 50 | |
T1 | n(CH4)/mol | 0.50 | 0.35 | 0.25 | 0.10 | 0.10 |
T2 | n(CH4)/mol | 0.50 | 0.30 | 0.18 | …… | 0.15 |
下列说法正确的是
A.T1时0~10minNO2的平均反应速率为0.15mol·L-1·min-1
B.T2时CH4的平衡转化率为70.0%
C.保持其他条件不变,T1时向平衡体系中再充入0.3molCH4和0.80molH2O(g),平衡向正反应方向移动
D.保持其他条件不变,T1时向平衡体系中再充入0.5molCH4和1.2molNO2,与原平衡相比,达新平衡时N2的浓度增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮、磷、砷(As)、锑(Sb)、铋(Bi)、镆(Mc)为元素周期表中原子序数依次增大的同族元素。回答下列问题:
(1)砷在元素周期表中的位置______。![]() 的中子数为________。
的中子数为________。
已知:P(s,白磷)=P(s,黑磷) ΔH=-39.3 kJ·mol-1;P(s,白磷)=P(s,红磷) ΔH=-17.6 kJ·mol-1;由此推知,其中最稳定的磷单质是________。
(2)氮和磷氢化物性质的比较:热稳定性:NH3________PH3(填“>”或“<”)。沸点:N2H4________P2H4(填“>”或“<”),判断依据是____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业废催化剂中含有多种金属元素,某废催化剂主要含有SiO2、ZnO、ZnS和CuS,为充分利用资源,变废为宝,在实验室中探究回收废催化剂中的锌和铜,具体流程如图所示,回答下列问题:
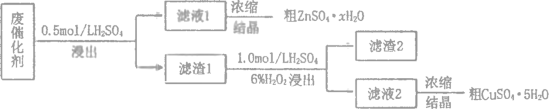
已知:ZnS与稀硫酸反应且化合价不变;CuS既不溶于稀硫酸也不与稀硫酸反应。
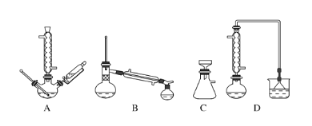
(1)下列玻璃仪器或装置中,第一次浸出时尾气净化需要使用的装置为___________(填标号),“浓缩结晶”需要使用的仪器是_______________(填名称)。
(2)滤渣1的主要成分是 ___________。
(3)第二次浸出时,向盛有滤渣1的反应器中先加入稀硫酸,后滴入过氧化氢溶液。反应器中有淡黄色沉淀生成,写出反应的离子方程式___________;若顺序相反,会造成___________。
(4)第二次浸出时需要加热且控温,采用的合适加热方式是___________。
(5)某同学在实验完成之后,得到23.3g提纯的硫酸锌晶体(ZnSO4·xH2O)。为确定晶体化学式,取5.0g晶体,用蒸馏水完全溶解.再加入足量的氯化钡溶液,充分反应后过滤、___________、___________、称重得固体4.1g,则硫酸锌晶体的化学式为___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在实验室里制取少量FeCl3,可按照一定顺序连接下图中所列装置,所通过的气体过量且反应充分。试回答以下问题:
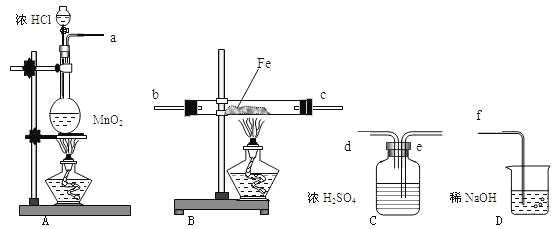
(1)实验时,各装置接口的连接顺序为___________________________(用a、b、c、d等字母表示);
(2)C装置的作用是________________________;
(3)D装置的作用是_____________________________________;
(4)检验B装置中反应后铁是否有剩余的方法是:_______________________;
(5)用此方法可制得无水氯化铁。你认为能否改用Fe和盐酸反应,再通入过量氯气、蒸干溶液的方法来制取无水氯化铁,________(答:是或否);说明理由:_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】不能正确表示下列变化的离子方程式的是
A.MnO2与浓盐酸加热:MnO2+4H++2Cl-![]() Mn2++Cl2↑+2H2O
Mn2++Cl2↑+2H2O
B.FeCl2溶液在空气中变质:12Fe2++3O2+6H2O=8Fe3++4Fe(OH)3↓
C.NaClO溶液中通入少量CO2:2ClO-+CO2+H2O=2HClO+CO32-
D.R-NH2电离:R-NH2+H2O![]() R-NH3++OH-
R-NH3++OH-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】药物阿比朵尔具有很好的抗病毒活性,其合成路线如下:
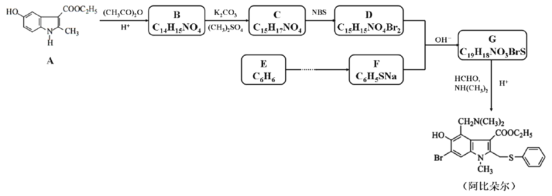
已知:①![]() +HCHO+
+HCHO+
![]()

②RX![]() RLiX
RLiX![]() RSH
RSH
请回答:
(1)下列说法正确的是___________。
A.化合物A能发生加成、取代和氧化反应,不发生还原反应
B.化合物B具有弱碱性
C.化合物D与FeCl3溶液发生显色反应
D.阿比朵尔的分子式是C22H25N2O3BrS
(2)写出化合物D的结构简式___________。
(3)写出G→阿比朵尔的化学方程式___________。
(4)设计从E→F的合成路线(用流程图表示,无机试剂任选)___________。
(5)写出化合物A同时符合下列条件的同分异构体的结构简式___________。
①1H-NMR谱和IR谱检测表明:分子中共有4种氢原子,含氮氧单键和碳氧双键;
②含有苯环和含氮五元杂环,且两环共棱连接。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com