
【题目】氯氧化铜[xCuO·yCuCl2·zH2O]在农业上用作杀菌剂。工业上用铜矿粉(主要含Cu2(OH)2CO3、Fe3O4等)为原料制取氯氧化铜的流程如下:
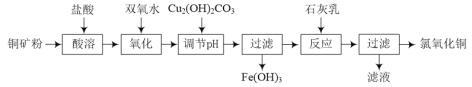
⑴“调节pH”并生成Fe(OH)3时反应的离子方程式为______。
⑵调节pH,要使常温溶液中c(Cu2+)≥0.022mol·L-1,而c(Fe3+)≤1×10-6mol·L-1,则应调节pH的范围为______。{已知Ksp[Cu(OH)2=2.2×10-20],Ksp[Fe(OH)3=1×10-36]}
⑶为测定氯氧化铜的组成,现进行如下实验:
步骤Ⅰ:称取0.4470 g氯氧化铜,放入锥形瓶,加入一定量30%的硝酸使固体完全溶解。滴加K2CrO4溶液作指示剂,用0.1000mol·L-1 AgNO3标准溶液滴定溶液中的Cl-,滴定至终点时消耗AgNO3标准溶液20.00 mL;
步骤Ⅱ:称取0.4470g氯氧化铜,放入锥形瓶,加入一定量硫酸使固体完全溶解。向溶液中加入过量的KI固体,充分反应后向溶液中滴入数滴淀粉溶液,用0.2000mol·L-1Na2S2O3标准溶液滴定,滴定至终点时消耗Na2S2O3标准溶液20.00mL。
已知步骤Ⅱ中所发生的反应如下:
2Cu2++4I-=2CuI↓+I2 2Na2S2O3+I2=2NaI+Na2S4O6
①已知Ag2CrO4为砖红色沉淀,步骤Ⅰ滴定终点时的实验现象是_______。
②通过计算确定氯氧化铜的化学式________________(写出计算过程)。
【答案】4Fe3++3Cu2(OH)2CO3+3H2O=4Fe(OH)3+6Cu2++3CO2↑ [4,5] 当加入最后一滴AgNO3溶液时,出现砖红色沉淀 3CuO·CuCl2·4H2O
【解析】
铜矿粉溶于盐酸溶液中,含有Cu2+、Fe2+、Fe3+,加双氧水将Fe2+氧化成Fe3+,此时溶液中存在着Fe3+的水解平衡,加入碱式碳酸铜调节pH值,使Fe3+转化成沉淀除去。加入石灰乳将Cu2+沉淀: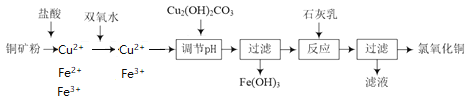
(1)Fe3+水解平衡:Fe3++3H2O![]() Fe(OH)3+3H+,Cu2(OH)2CO3消耗H+, H+浓度减小使平衡正向移动, Fe3+转化成氢氧化铁沉淀而除去,Cu2(OH)2CO3+4H+=2Cu2++CO2↑+3H2O,将俩方程式加和就得到了:4Fe3++3Cu2(OH)2CO3+3H2O=4Fe(OH)3+6Cu2++3CO2↑。
Fe(OH)3+3H+,Cu2(OH)2CO3消耗H+, H+浓度减小使平衡正向移动, Fe3+转化成氢氧化铁沉淀而除去,Cu2(OH)2CO3+4H+=2Cu2++CO2↑+3H2O,将俩方程式加和就得到了:4Fe3++3Cu2(OH)2CO3+3H2O=4Fe(OH)3+6Cu2++3CO2↑。
(2)使溶液中的Fe3+完全变成沉淀时的pH计算:Ksp[Fe(OH)3]=1×10-36=c(Fe3+)×c3(OH—),c(Fe3+)=1×10-6molL—1,解得c(OH—)=1×10—10molL—1,pH=4;使常温溶液中c(Cu2+)≥0.022mol·L-1 pH计算:Ksp[Cu (OH)2]=2.2×10—20=c(Cu2+)×c2(OH—),c(Cu2+)=0.022molL—1,解得c(OH—)=1×10—9molL—1,pH=5;故pH 范围:[4,5]。
(3)①当氯离子已沉淀完全,多加入一滴AgNO3溶液时,CrO42—开始沉淀出现砖红色。
②n(Cl—)=n(AgNO3)=0.1000 mol·L-1×0.02 L=0.002 mol,由方程式知:Cu2+ ~ Na2S2O3,n(Cu2+ ) = n(Na2S2O3)= 0.2000 mol·L-1×0.02 L=0.004 mol,结合氯氧化铜化学式[xCuO·yCuCl2·zH2O]得:n(CuO)= 0.003 mol,n(CuCl2)= 0.001 mol,
n(H2O)=![]() = 0.004 mol,n(CuO):n(CuCl2):n(H2O)=x:y:z=3:1:4,故氯氧化铜的化学式:3CuO·CuCl2·4H2O
= 0.004 mol,n(CuO):n(CuCl2):n(H2O)=x:y:z=3:1:4,故氯氧化铜的化学式:3CuO·CuCl2·4H2O


 赢在课堂名师课时计划系列答案
赢在课堂名师课时计划系列答案科目:高中化学 来源: 题型:
【题目】氮化钙(Ca3N2)是一种重要的化学试剂,通常条件下为棕色易水解的固体。某小组在实验室制备氮化钙并测定其纯度,设计如下实脸(夹持装置略去):
I.氮化钙的制备。
(1)加热条件下,钙和氮气制备氮化钙的反应方程式为_________。

(2)按气流由左到右的方向,上述装置合理的连接顺字为__________(填仪器接口字母)。
(3)按连接好的装置进行实验。
①实验步骤如下,检查装置气密性,加入药品:_______(请按正确顺序填入下列步骤的字母标号)。
a.点燃装置C处酒精灯,反应一段时间
b.打开分液漏斗活塞
c.点燃装置A处酒精灯
d.熄灭装置A处酒精灯
e.熄灭装置C处酒精灯
f.关闭分液漏斗活塞
②装置B的作用为_________。
③装置C的硬质玻璃管中的现象为_________。
(4)设计实验证明Ca3N2中混有钙单质:_______________。
II.测定氮化钙纯度。
i.称取4.0g反应后的固体,加入足量水,将生成的气体全部蒸出并通入100.00mL 1 .00mol/L盐酸中,充分反应后,将所得溶液稀释到200 . 00 mL;
ii.取20 . 00mL稀释后的溶液,用0 . 2mol/LNaOH标准溶液滴定过量的盐酸,到终点时消耗标准溶液25 . 00 mL。
(5)所取固体中氮化钙的质量分数为_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯苯是染料、医药、有机合成的中间体,是重要的有机化工产品。实验室制取氯苯如图所示(加热和固定仪器的装置略去)。
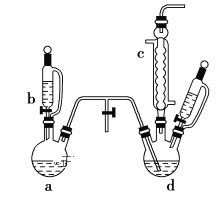
(1)a和b仪器组合成制取氯气的装置,反应无需加热,则a仪器中的固体反应物可以是__________;仪器c的名称是___________。
(2)把氯气通入反应器d中(d仪器中有FeCl3和苯),加热维持反应温度为40~60 ℃,温度过高会生成过多副产物的二氯苯。对d加热的方法是_____________。
(3)制取氯苯的化学方程式为_____________________________________________。
(4)仪器c出口的气体成分除了少量苯蒸气、水蒸气外,还有_________________。
(5) 仪器d中的反应完成后,工业上要进行水洗、碱洗及干燥。
①水洗的目的是除去混合物中混有的_____________________杂质。
②10% NaOH溶液碱洗是除去混合物中的_____________________。
(6)实验最后想要得到纯净氯苯的提纯方法是____________________。
(7)指出该实验装置的一个缺点__________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下分别向20.00 mL 0.1000 mol·L-1的氨水、醋酸铵溶液中滴加0.1000mol·L-1的盐酸,溶液pH与加入盐酸体积的变化关系如图所示。下列说法正确的是

A. M点溶液中c (OH-)>c(NH4+)>c(NH3·H2O)>c(H+)
B. N点溶液中c(NH4+)>c(NH3·H2O)>c(Cl-)>c(OH-)
C. P点溶液中c(NH4+)>2c(CH3COO-)+c(NH3·H2O)
D. Q点溶液中2c(Cl-)>c(CH3COOH)+c(NH4+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锗是第四周期第ⅣA族元素,锗是重要的半导体材料,用于制造晶体管及各种电子装置。下图为以锗锌矿(含GeO2、ZnS及少量Fe2O3)为原料生产高纯度锗的工艺流程如下:

已知:GeO2可溶于强碱溶液,生成锗酸盐。GeCl4的熔点为-49.5℃,沸点为84℃,在水中或酸的稀溶液中易水解。
回答下列问题:
(1)步骤①中提高碱浸效率的措施有______________________(写一种),NaOH溶液碱浸时发生反应的离子方程式为______________________。
(2)操作a的名称是___________,GeCl4的电子式为_______________。
(3)滤渣1中除含有ZnS外,还含有少量___________。滤渣2中除含有 CaGeO3外,还含有少量___________。
(4)步骤⑤中加入浓盐酸,发生反应的化学方程式为______________________。不用稀盐酸的原因是______________________。
(5)写出一种证明步骤⑧反应完全的操作方法:______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、W为原子序数依次增大的短周期主族元素,Y、Z同周期且相邻,X、W同主族且与Y处于不同周期,Y、Z原子的电子数总和与X、W原子的电子数总和之比为5:4。化合物WYZ2是一种工业盐,对人体危害很大。下列叙述正确的是
A.简单氢化物的沸点:Y<Z
B.化合物WY3中只存在离子键
C.原子半径:W>Z>Y>X
D.X2Z与W2Z2发生的反应中,X2Z被氧化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,在2 L的密闭容器中,加入4 mol A和2 mol B进行如下反应:3A(g)+2B(g) ![]() 4C(s)+2D(g),反应一段时间后达到平衡,测得生成1.6 mol C,下列说法正确的是
4C(s)+2D(g),反应一段时间后达到平衡,测得生成1.6 mol C,下列说法正确的是
A.该反应的化学平衡常数表达式是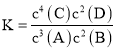
B.增加B,平衡向右移动,B的平衡转化率增大
C.增大该体系的压强,平衡向右移动,化学平衡常数增大
D.此时,B的平衡转化率是40%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求填空:
(1)写出FeCl3水解反应的离子方程式_________。
(2)写出草酸使酸性高锰酸钾溶液褪色反应的离子方程式______。
(3)通常状况1mol葡萄糖(C6H12O6)完全氧化可放出2804kJ的热量,写出葡萄糖燃烧热的热化学方程式_____。
(4)泡沫灭火器中所用试剂为硫酸铝溶液和碳酸氢钠溶液,请写出灭火时两溶液混合反应的化学方程式_____。
(5)H3PO2是一种化工产品。
①H3PO2为一元中强酸,写出其电离方程式:_________。
②NaH2PO2为____(填“正盐”或“酸式盐”),其溶液显____(填“弱酸性”、“中性”或“弱碱性”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】目前手机屏幕主要由保护玻璃、触控层以及下面的液晶显示屏三部分组成。下面是工业上用丙烯(A)和有机物C(C7H6O3)为原料合成液晶显示器材料(F)的主要流程:
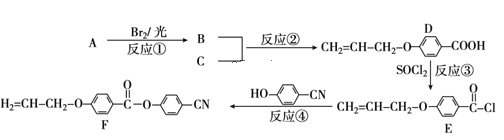
(1)化合物C的结构简式为___。B的官能团名称___。
(2)上述转化过程中属于取代反应的有___(填反应序号)。
(3)写出B与NaOH水溶液反应的化学方程式___。
(4)下列关于化合物D的说法正确的是___(填字母)。
A.属于酯类化合物 B.1molD最多能与4molH2发生加成反应
C.一定条件下发生加聚反应 D.核磁共振氢谱有5组峰
(5)写出符合下列条件下的化合物C的同分异构体的结构简式___(任写一种)。
①苯环上一溴代物只有2种 ②能发生银镜反应 ③苯环上有3个取代基
(6)请参照上述制备流程,写出以有机物C和乙烯为原料制备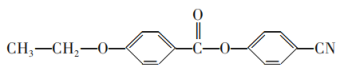 的合成路线流程图(无机试剂任用)___。
的合成路线流程图(无机试剂任用)___。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com