
����Ŀ�����ǵ������ڵ���A��Ԫ�أ�������Ҫ�İ뵼����ϣ��������쾧��ܼ����ֵ���װ�á���ͼΪ����п��(��GeO2��ZnS������Fe2O3)Ϊԭ�������ߴ�����Ĺ����������£�

��֪��GeO2������ǿ����Һ�����������Ρ�GeCl4���۵�Ϊ��49.5�����е�Ϊ84������ˮ�л����ϡ��Һ����ˮ�⡣
�ش��������⣺
(1)������������Ч�ʵĴ�ʩ��______________________(дһ��)��NaOH��Һ���ʱ������Ӧ�����ӷ���ʽΪ______________________��
(2)����a��������___________��GeCl4�ĵ���ʽΪ_______________��
(3)����1�г�����ZnS�⣬����������___________������2�г����� CaGeO3�⣬����������___________��
(4)�������м���Ũ���ᣬ������Ӧ�Ļ�ѧ����ʽΪ______________________������ϡ�����ԭ����______________________��
(5)д��һ��֤����������Ӧ��ȫ�IJ���������______________________��
���𰸡�����ʯ����(����Ȼ��ֽ���) GeO2+ 2OH- =GeO32-+H2O ����  Fe2O3 Ca(OH)2 CaGeO3+6HCl(Ũ)=CaCl2+ CeCl4+3H2O GeCl4��ϡ��������ˮ�� ����Ӧ���ɵ�����ͨ��װ����ˮ����ͭ��U�ιܣ�����δ����
Fe2O3 Ca(OH)2 CaGeO3+6HCl(Ũ)=CaCl2+ CeCl4+3H2O GeCl4��ϡ��������ˮ�� ����Ӧ���ɵ�����ͨ��װ����ˮ����ͭ��U�ιܣ�����δ����
��������
�����п��(��Ҫ�ɷ�GeO2��ZnS������Fe2O3)������Һ�к��������Σ������Ȼ�����Һ��Ӧ�γ�CaGeO3���������˺�õ�CaGeO3����CaGeO3��Ũ�����ܽ�����GeCl4��GeCl4��Ũ�������ܽ�ȵͣ����˺�õ�GeCl4��GeCl4�ڴ�ˮ��ˮ������GeO2nH2O��GeO2nH2O��ˮ��õ�GeO2�����������Ȼ�ԭGeO2�õ��ߴ���Ge���ݴ˷������
(1)�����������Ч�ʵĴ�ʩ�н���ʯ�������Ȼ��ֽ��裬NaOH��Һ���ʱ����GeO2�ܽ����������Σ���Ӧ�����ӷ���ʽΪGeO2+ 2OH- =GeO32-+H2O���ʴ�Ϊ������ʯ����(����Ȼ��ֽ���)��GeO2+ 2OH- =GeO32-+H2O��
(2)����aΪ������Һ�������Ϊ���˲�����GeCl4���۵�Ϊ��49.5�棬�е�Ϊ84�棬Ϊ���Ӿ��壬���й��ۼ�������ʽΪ ���ʴ�Ϊ�����ˣ�
���ʴ�Ϊ�����ˣ� ��
��
(3)�������������������ƣ�����1�г�����ZnS�⣬����������Fe2O3��������������ˮ���Ȼ����ܹ����������Ʒ�Ӧ�����������Ƴ������������2�г����� CaGeO3�⣬����������Ca(OH)2���ʴ�Ϊ��Fe2O3��Ca(OH)2��
(4)��������ͼ��������м���Ũ���ᣬ��Ӧ����CeCl4����Ӧ�Ļ�ѧ����ʽΪCaGeO3+6HCl(Ũ)=CaCl2+ CeCl4+3H2O��GeCl4��ϡ��������ˮ�⣬��˲���ϡ�����ܽ⣬�ʴ�Ϊ��CaGeO3+6HCl(Ũ)=CaCl2+ CeCl4+3H2O��GeCl4��ϡ��������ˮ�⣻
(5)����������������Ȼ�ԭGeO2�õ��ߴ���Ge������Ӧ��ȫ���ٲ���ˮ���������Խ���Ӧ���ɵ�����ͨ��װ����ˮ����ͭ��U�ιܣ�����δ����������֤����Ӧ�Ѿ���ȫ���ʴ�Ϊ������Ӧ���ɵ�����ͨ��װ����ˮ����ͭ��U�ιܣ�����δ������


 һ����������ϵ�д�
һ����������ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵����ȷ���ǣ�������
A.����ƽ�ⳣ�����Ա�ʾ������ʵ����ǿ��
B.����ƽ�ⳣ������ҺŨ�ȵ�Ӱ��
C.H2CO3�ĵ��볣������ʽ��K=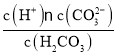
D.���볣���������Һ��c(H��)һ���ȵ��볣��С�����д�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
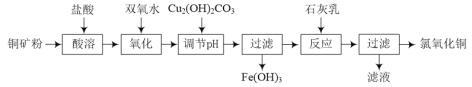
����Ŀ����ҵ���Ը�����(��Ҫ�ɷ���FeO��Cr2O3��������MgCO3��Al2O3��SiO2��)Ϊԭ����ȡ������(Na2CrO4)���壬�乤���������£�

��֪������3��Cr��������Һ�������ȶ�����pH>9ʱ��CrO![]() ��ʽ�������ױ�������
��ʽ�������ױ�������
�������£�����������������������ʽ����ʱ��Һ��pH���£�
������ | Fe3�� | Fe2�� | Mg2�� | Al3�� | Cr3�� |
��ʼ����ʱ��pH | 1��9 | 7��0 | 9��1 | �� | �� |
������ȫʱ��pH | 3��2 | 9��0 | 11��1 | 4��7(>10�ܽ�) | 5��6(>9�ܽ�) |
(1)���������ʵĴ�ʩ��__________________________________(������)��
(2)����1����Ҫ�ɷ���_____������2����Ҫ�ɷ���_____������3����Ҫ�ɷ���_____��
(3)����������ʹ����H2O2����������H2O2�ĵ���ʽΪ___________����һ������ʱ��Ӧ�����ӷ���ʽΪ_____________________���ڶ�������ʱĿ����____________________��
(4)����ͼ���� ���ڵIJ�����________________��ϴ�ӡ����
(5)��ȥ���Է�ˮ�к��е�Cr2O72-����ʹ��FeSO4����÷�Ӧ�����Һ�к�Cr3����Fe2����Fe3����H���������ӡ��÷�Ӧ�����ӷ���ʽΪ_________________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����л�ѧ����ʽ�����ӷ���ʽ��ȷ����( )
A.�ô���ȥ��ˮ����CaCO3+2H+=Ca2++H2O+CO2��
B.��ȩ����������Cu(OH)2��Һ��Ӧ��HCHO+2Cu(OH)2![]() HCOOH+Cu2O��+2H2O
HCOOH+Cu2O��+2H2O
C.ʵ������Һ��ͱ��ڴ������������屽��![]() +Br2
+Br2![]()
![]() +HBr
+HBr
D.��CO2ͨ�뱽������Һ��2![]() +CO2+H2O��2
+CO2+H2O��2![]() +Na2CO3
+Na2CO3
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������M��![]() ����N��
����N��![]() ����P��
����P��![]() ��������Ҫ���л�������й�M��N��P��˵����ȷ���ǣ� ��
��������Ҫ���л�������й�M��N��P��˵����ȷ���ǣ� ��
A.M��HBr�����ӳɷ�Ӧ�IJ���ֻ��һ��
B.P������̼ԭ��һ����ƽ��
C.M��N��P��Ϊͬ���칹��
D.M��ʹ���Ը��������Һ��ɫ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������ͭ[xCuO��yCuCl2��zH2O]��ũҵ������ɱ��������ҵ����ͭ��ۣ���Ҫ��Cu2(OH)2CO3��Fe3O4�ȣ�Ϊԭ����ȡ������ͭ���������£�
�š�����pH��������Fe(OH)3ʱ��Ӧ�����ӷ���ʽΪ______��
�Ƶ���pH��Ҫʹ������Һ��c(Cu2��)��0.022mol��L-1����c(Fe3��)��1��10��6mol��L-1����Ӧ����pH�ķ�ΧΪ______������֪Ksp[Cu(OH)2��2.2��10��20]��Ksp[Fe(OH)3��1��10��36]��
��Ϊ�ⶨ������ͭ����ɣ��ֽ�������ʵ�飺
�����ȡ0.4470 g������ͭ��������ƿ������һ����30%������ʹ������ȫ�ܽ⡣�μ�K2CrO4��Һ��ָʾ������0.1000mol��L��1 AgNO3����Һ�ζ���Һ�е�Cl�����ζ����յ�ʱ����AgNO3����Һ20.00 mL��
�����ȡ0.4470g������ͭ��������ƿ������һ��������ʹ������ȫ�ܽ⡣����Һ�м��������KI���壬��ַ�Ӧ������Һ�е������ε�����Һ����0.2000mol��L��1Na2S2O3����Һ�ζ����ζ����յ�ʱ����Na2S2O3����Һ20.00mL��
��֪��������������ķ�Ӧ���£�
2Cu2+��4I����2CuI����I2 2Na2S2O3��I2��2NaI��Na2S4O6
����֪Ag2CrO4Ϊש��ɫ�����������ζ��յ�ʱ��ʵ��������_______��
��ͨ������ȷ��������ͭ�Ļ�ѧʽ________________��д��������̣���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��һ�ֹ⻯ѧ��صĽṹ��ͼ��ʾ������ܷ�ӦΪAgCl(s)+ Cu+(aq) = Ag(s)+Cu2+(aq)+Cl-(aq)�����й��ڸõ���ڹ���ʱ��˵���в���ȷ����
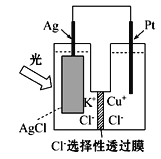
A.���ӵ��˶�����Pt�����·��Ag���ڵ�·��PtB.����108 g����ת�Ƶĵ���Ϊ1 mol
C.Cu+�ڸ�������������ӦD.Cl-������Ǩ�Ƶ�����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����������(Na2S2O3)���Գ�ȥ����ˮ�е���������ˮ����ֳ�ϱ��㷺Ӧ�á��ô������(��Ҫ�ɷ�Na2S��������Na2SO4��Na2CO3��)Ϊԭ���Ʊ�Na2S2O3��5H2O��ʵ���������£�
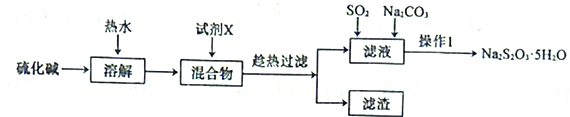
�ش��������⣺
(1)�Լ�X��һ�ֶ�Ԫ������ı��Σ�����Na2SO4��Ӧ�Ļ�ѧ����ʽΪ___________________��
(2)����ˮ�ܽⲢ���ȹ��˵�Ŀ����______________________��
(3)����SO2��Na2CO3��Na2S�Ļ����Һ��Ӧ�Ʊ�Na2S2O3��������������ͼ��
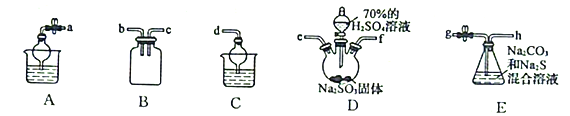
�����������Ӹ����������ܵĽӿ�˳��Ϊ��___________��e��f��___________��___________��___________��___________��d��___________
��E�з�����Ӧ�����ӷ���ʽΪ______________________��
��װ��B��������______________________��
(4)����1��������Ũ����______________________��___________��ϴ�ӡ�����
(5)Ϊ�ⶨ��ƷNa2S2O3��5H2O�Ĵ��ȣ�ȷ��ȡ12.4gNa2S2O3��5H2O��Ʒ�����Ƴ�100mL��Һ��ȡ25.00mL��Һ���Ե�����Һ��ָʾ������0.2500mol��L��1��ı���Һ�ζ���������Ӧ2S2O32��+I2= S4O62��+2I�������ĵ�ı���Һ20.00mL����ò�Ʒ�Ĵ���Ϊ___________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵����ȷ���ǣ� ��
A.��ϵͳ������![]() ������Ϊ2һ��һ3��5һ���һ�����
������Ϊ2һ��һ3��5һ���һ�����
B.��Na2CO3��Һ������CH3COOH��CH3CH2OH��������������������
C.�������ļ��顢��ϩ��1��3һ����ϩ�ֱ���ȼ�գ���������������������
D.�������ʵķе㰴�ɵ͵���˳��Ϊ��(CH3CH2)2CH2��(CH3)3CH��CH3(CH2)3CH3��(CH3)2CHCH2CH3
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com