
【题目】下列化学方程式或离子方程式正确的是( )
A.用醋酸去除水垢:CaCO3+2H+=Ca2++H2O+CO2↑
B.甲醛与足量新制Cu(OH)2浊液反应:HCHO+2Cu(OH)2![]() HCOOH+Cu2O↓+2H2O
HCOOH+Cu2O↓+2H2O
C.实验室用液溴和苯在催化剂作用下制溴苯:![]() +Br2
+Br2![]()
![]() +HBr
+HBr
D.将CO2通入苯酚钠溶液:2![]() +CO2+H2O→2
+CO2+H2O→2![]() +Na2CO3
+Na2CO3
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】单质硫在NaOH的热浓溶液中发生歧化反应,将2.56g硫与含0.0600molNaOH的热溶液反应恰好生成amolNa2Sx和bmolNa2S2O3,再加入1.00mol/L的NaClO溶液VmL,使溶液中所有硫元素全部转化为Na2SO4。计算:(1)a/b=________;
(2)V至少为___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有前四周期T、X、Y、Z、W、M六种元素,已知W、Z、X、T、Y五种非金属元素原子半径依次减小,其中W原子的s电子总数等于p电子总数的2倍,M原子的M能层上有4个未成对电子。请回答下列问题:
(1)写出W、Z、X、T四种元素第一电离能由大到小的顺序:____________(用元素符号表示)。
(2)基态M原子的核外电子排布式为__________________________。
(3)根据VSEPR理论,推断出由W与X两元素组成的最简单二价阴离子的立体构型为____________,W原子的杂化类型为____________。
(4)Y与T、X、Z、W所形成的最简单化合物的沸点由高到低的顺序为__________________________(用化学式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯苯是染料、医药、有机合成的中间体,是重要的有机化工产品。实验室制取氯苯如图所示(加热和固定仪器的装置略去)。
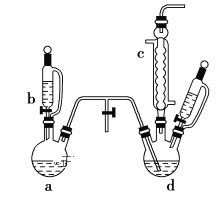
(1)a和b仪器组合成制取氯气的装置,反应无需加热,则a仪器中的固体反应物可以是__________;仪器c的名称是___________。
(2)把氯气通入反应器d中(d仪器中有FeCl3和苯),加热维持反应温度为40~60 ℃,温度过高会生成过多副产物的二氯苯。对d加热的方法是_____________。
(3)制取氯苯的化学方程式为_____________________________________________。
(4)仪器c出口的气体成分除了少量苯蒸气、水蒸气外,还有_________________。
(5) 仪器d中的反应完成后,工业上要进行水洗、碱洗及干燥。
①水洗的目的是除去混合物中混有的_____________________杂质。
②10% NaOH溶液碱洗是除去混合物中的_____________________。
(6)实验最后想要得到纯净氯苯的提纯方法是____________________。
(7)指出该实验装置的一个缺点__________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】1,2-二溴乙烷在常温下是无色液体,密度是2.18g/cm3,沸点是131.4℃,熔点是9.79℃,不溶于水,易溶于醇、丙酮等有机溶剂.在实验室可用如图所示装置来制备1,2-二溴乙烷.其中试管c中装有浓溴水.
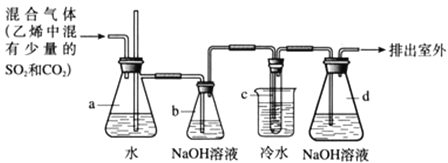
(1)写出制备1,2-二溴乙烷的化学方程式__________________________________;该反应属于______
反应(填反应类型);
(2)安全瓶a可以防止倒吸,并可以检查实验进行时试管c是否发生堵塞.如果发生堵塞,a中的现象是:____________________;
(3)容器b中NaOH溶液的作用是____________________;
(4)将试管c置于冷水中的目的是____________________;
(5)容器d中NaOH溶液的作用是____________________,所发生反应的离子方程式为
________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下分别向20.00 mL 0.1000 mol·L-1的氨水、醋酸铵溶液中滴加0.1000mol·L-1的盐酸,溶液pH与加入盐酸体积的变化关系如图所示。下列说法正确的是

A. M点溶液中c (OH-)>c(NH4+)>c(NH3·H2O)>c(H+)
B. N点溶液中c(NH4+)>c(NH3·H2O)>c(Cl-)>c(OH-)
C. P点溶液中c(NH4+)>2c(CH3COO-)+c(NH3·H2O)
D. Q点溶液中2c(Cl-)>c(CH3COOH)+c(NH4+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锗是第四周期第ⅣA族元素,锗是重要的半导体材料,用于制造晶体管及各种电子装置。下图为以锗锌矿(含GeO2、ZnS及少量Fe2O3)为原料生产高纯度锗的工艺流程如下:

已知:GeO2可溶于强碱溶液,生成锗酸盐。GeCl4的熔点为-49.5℃,沸点为84℃,在水中或酸的稀溶液中易水解。
回答下列问题:
(1)步骤①中提高碱浸效率的措施有______________________(写一种),NaOH溶液碱浸时发生反应的离子方程式为______________________。
(2)操作a的名称是___________,GeCl4的电子式为_______________。
(3)滤渣1中除含有ZnS外,还含有少量___________。滤渣2中除含有 CaGeO3外,还含有少量___________。
(4)步骤⑤中加入浓盐酸,发生反应的化学方程式为______________________。不用稀盐酸的原因是______________________。
(5)写出一种证明步骤⑧反应完全的操作方法:______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,在2 L的密闭容器中,加入4 mol A和2 mol B进行如下反应:3A(g)+2B(g) ![]() 4C(s)+2D(g),反应一段时间后达到平衡,测得生成1.6 mol C,下列说法正确的是
4C(s)+2D(g),反应一段时间后达到平衡,测得生成1.6 mol C,下列说法正确的是
A.该反应的化学平衡常数表达式是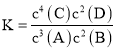
B.增加B,平衡向右移动,B的平衡转化率增大
C.增大该体系的压强,平衡向右移动,化学平衡常数增大
D.此时,B的平衡转化率是40%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】早期发现的一种天然二十面体准晶颗粒由Al、Cu、Fe三种金属元素组成,回答下列问题:
(1)准晶是一种无平移周期序,但有严格准周期位置序的独特晶体,可通过_______方法区分晶体、准晶体和非晶体。
(2)基态铜原子的电子排布式为_______。
(3)CuO在高温时分解为O2和Cu2O,请从阳离子的结构来说明在高温时,Cu2O比CuO更稳定的原因是_______。Cu2O为半导体材料,在其立方晶胞内部有4个氧原子,其余氧原子位于面心和顶点,则该晶胞中有_______个铜原子。
(4)Cu2+能与乙二胺(H2N—CH2—CH2—NH2)形成配离子如图:![]() ,该配离子中含有的化学键类型有______(填字母序号)。
,该配离子中含有的化学键类型有______(填字母序号)。
A.配位键 B.极性键 C.离子键 D.非极性键
(5)羰基铁[Fe(CO)5]可用作催化剂、汽油抗暴剂等。1molFe(CO)5分子中含____molσ键,与CO互为等电子体的离子是__(填化学式,写一种)。
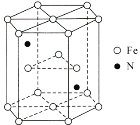
(6)某种磁性氮化铁的结构如图所示,N随机排列在Fe构成的正四面体空隙中。正六棱柱底边长为acm,高为ccm,阿伏加德罗常数的值为NA,则该磁性氮化铁的晶体密度为____g/cm3(列出计算式)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com