
【题目】现有前四周期T、X、Y、Z、W、M六种元素,已知W、Z、X、T、Y五种非金属元素原子半径依次减小,其中W原子的s电子总数等于p电子总数的2倍,M原子的M能层上有4个未成对电子。请回答下列问题:
(1)写出W、Z、X、T四种元素第一电离能由大到小的顺序:____________(用元素符号表示)。
(2)基态M原子的核外电子排布式为__________________________。
(3)根据VSEPR理论,推断出由W与X两元素组成的最简单二价阴离子的立体构型为____________,W原子的杂化类型为____________。
(4)Y与T、X、Z、W所形成的最简单化合物的沸点由高到低的顺序为__________________________(用化学式表示)。
【答案】)F>N>O>C 1s22s22p63s23p63d64s2(或[Ar]3d64s2) 平面三角形 sp2 H2O>HF>NH3>CH4
【解析】
根据题中信息“W原子的s电子总数等于p电子总数的2倍”可知,W的电子排布式是1s22s22p2,则W是碳元素;又知“W、Z、X、T、Y五种非金属元素原子半径依次减小”,根据元素周期律可推知Z是氮元素,X是氧元素,T是氟元素,Y是氢元素;“M原子的M能层上有4个未成对电子”,则M的电子排布式是1s22s22p63s23p63d64s2,即M是铁元素。
(1)C、N、O、F四种元素位于同一周期,随原子序数增大,第一电离能呈增大趋势,但N元素反常,它的第一电离能比O大,但比F小。
(2) 基态M原子的核外电子排布式为1s22s22p63s23p63d64s2或[Ar] 3d64s2;
(3)C和O两种元素组成的最简单的二价阴离子是![]() ,该离子的中心原子的价层电子对数是3,孤电子对数是0,由此可确定其立体构型和杂化类型。
,该离子的中心原子的价层电子对数是3,孤电子对数是0,由此可确定其立体构型和杂化类型。
(4)H与F、O、N、C所形成的最简单化合物分别是HF、H2O、NH3、CH4,其中HF、H2O、NH3分子之间都存在氢键,它们的沸点都比没有氢键的CH4高,常温下H2O为液态,HF、NH3为气态,标准状况下HF为液态,NH3仍为气态,由此可得四种氢化物的沸点由高到低的顺序。
根据题中信息“W原子的s电子总数等于p电子总数的2倍”可知,W的电子排布式是1s22s22p2,则W是碳元素;又知“W、Z、X、T、Y五种非金属元素原子半径依次减小”,根据元素周期律可推知Z是氮元素,X是氧元素,T是氟元素,Y是氢元素;“M原子的M能层上有4个未成对电子”,则M的电子排布式是1s22s22p63s23p63d64s2,即M是铁元素。
(1)C、N、O、F四种元素位于同一周期,随原子序数增大,第一电离能呈增大趋势,但N元素反常,因此第一电离能由大到小的顺序是F>N>O>C;答案为:F>N>O>C;
(2) 基态M原子的核外电子排布式为1s22s22p63s23p63d64s2;答案为:1s22s22p63s23p6或[Ar] 3d64s2;
(3)C和O两种元素组成的最简单的二价阴离子是![]() ,该离子的中心原子的价层电子对数是3,孤电子对数是0,因此其立体构型是平面三角形,C原子的杂化类型为sp2杂化。
,该离子的中心原子的价层电子对数是3,孤电子对数是0,因此其立体构型是平面三角形,C原子的杂化类型为sp2杂化。
(4)H与F、O、N、C所形成的最简单化合物分别是HF、H2O、NH3、CH4,其中HF、H2O、NH3分子之间都存在氢键,它们的沸点都比没有氢键的CH4高,常温下H2O为液态,HF、NH3为气态,标准状况下HF为液态,NH3仍为气态,因此四种氢化物的沸点由高到低的顺序为H2O>HF>NH3>CH4。


科目:高中化学 来源: 题型:
【题目】向葡萄酒中加入Na2S2O5抗氧化。测定某葡萄酒中Na2S2O5残留量的方法:取50.00ml葡萄酒样品,用0.0100molL-1的碘标准液滴定至终点,消耗标准液10.00ml。则该样品中Na2S2O5的残留量为![]() 已知
已知![]()
![]()
A.0.001gL-1B.0.002gL-1C.0.064gL-1D.0.19gL-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.电离平衡常数可以表示弱电解质的相对强弱
B.电离平衡常数受溶液浓度的影响
C.H2CO3的电离常数表达式:K=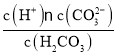
D.电离常数大的酸溶液中c(H+)一定比电离常数小的酸中大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某有机物结构简式为![]() ,下列叙述不正确的是( )
,下列叙述不正确的是( )
A.1mol该有机物在加热和催化剂作用下,最多能和4molH2反应
B.该有机物能使溴水褪色,也能使酸性KMnO4溶液褪色
C.该有机物在一定条件下能发生消去反应或取代反应
D.该有机物遇硝酸银溶液产生白色沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】稀氨水中存在着下列平衡:NH3·H2O![]() NH4++OH-,若要使平衡向逆反应方向移动,同时使c(OH-)增大,应加入的物质或采取的措施是
NH4++OH-,若要使平衡向逆反应方向移动,同时使c(OH-)增大,应加入的物质或采取的措施是
①NH4Cl固体;②硫酸;③NaOH固体;④水;⑤加热;⑥加入少量MgSO4固体。
A. ①②③⑤ B. ③⑥ C. ③ D. ③⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(选修3:物质结构与性质)
工业上用合成气(CO和H2)制取乙醇的反应为2CO+4H2![]() CH3CH2OH+H2O。研究发现,使用TiO2作为载体负载铑基催化剂具有较高的乙醇产量。回答下列问题:
CH3CH2OH+H2O。研究发现,使用TiO2作为载体负载铑基催化剂具有较高的乙醇产量。回答下列问题:
(1)Ti基态原子核外电子排布式为_______。和O同一周期且元素的第一电离能比O大的有_____(填元素符号),和O同一周期且基态原子核外未成对电子数比O多的有____(填元素符号)。
(2)在用合成气制取乙醇反应所涉及的4种物质中,沸点从低到高的顺序为______________。
(3)工业上以CO、O2、NH3为原料,可合成氮肥尿素[CO(NH2)2],CO(NH2)2分子中含有的σ键与π键的数目之比为_________。
(4)C元素与N元素形成的某种晶体的晶胞如图所示(8个碳原子位于立方体的顶点,4个碳原子位于立方体的面心,4个氮原子在立方体内),该晶体硬度超过金刚石,成为首屈一指的超硬新材料。
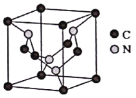
①该晶体的化学式为______;其硬度超过金刚石的原因是___________。
②已知该晶胞的密度为d g/cm3,N原子的半径为r1cm,C原子的半径为r2cm,设NA为阿伏加德罗常数,则该晶胞的空间利用率为__________________(用含d、r1、r2、NA的代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上以铬铁矿(主要成分是FeO·Cr2O3,含少量MgCO3、Al2O3、SiO2等)为原料制取铬酸钠(Na2CrO4)晶体,其工艺流程如下:

已知:①+3价Cr在酸性溶液中性质稳定,当pH>9时以CrO![]() 形式存在且易被氧化。
形式存在且易被氧化。
②常温下,部分阳离子以氢氧化物形式沉淀时溶液的pH如下:
阳离子 | Fe3+ | Fe2+ | Mg2+ | Al3+ | Cr3+ |
开始沉淀时的pH | 1.9 | 7.0 | 9.1 | — | — |
沉淀完全时的pH | 3.2 | 9.0 | 11.1 | 4.7(>10溶解) | 5.6(>9溶解) |
(1)提高酸浸速率的措施有__________________________________(答两条)。
(2)滤渣1的主要成分是_____;滤渣2的主要成分是_____;滤渣3的主要成分是_____。
(3)流程中两次使用了H2O2进行氧化,H2O2的电子式为___________;第一次氧化时反应的离子方程式为_____________________;第二次氧化时目的是____________________。
(4)流程图中“ ”内的操作是________________、洗涤、干燥。
(5)除去酸性废水中含有的Cr2O72-可以使用FeSO4,测得反应后的溶液中含Cr3+、Fe2+、Fe3+、H+等阳离子。该反应的离子方程式为_________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列化学方程式或离子方程式正确的是( )
A.用醋酸去除水垢:CaCO3+2H+=Ca2++H2O+CO2↑
B.甲醛与足量新制Cu(OH)2浊液反应:HCHO+2Cu(OH)2![]() HCOOH+Cu2O↓+2H2O
HCOOH+Cu2O↓+2H2O
C.实验室用液溴和苯在催化剂作用下制溴苯:![]() +Br2
+Br2![]()
![]() +HBr
+HBr
D.将CO2通入苯酚钠溶液:2![]() +CO2+H2O→2
+CO2+H2O→2![]() +Na2CO3
+Na2CO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫代硫酸钠(Na2S2O3)可以除去自来水中的氯气,在水产养殖上被广泛应用。用纯碱和硫化碱(主要成分Na2S,含少量Na2SO4、Na2CO3等)为原料制备Na2S2O3·5H2O的实验流程如下:
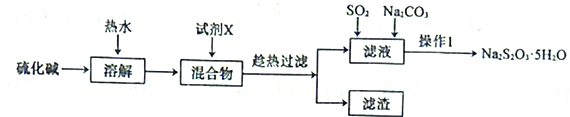
回答下列问题:
(1)试剂X是一种二元化合物的钡盐,它与Na2SO4反应的化学方程式为___________________。
(2)用热水溶解并趁热过滤的目的是______________________。
(3)利用SO2与Na2CO3、Na2S的混合溶液反应制备Na2S2O3,所需仪器如下图:
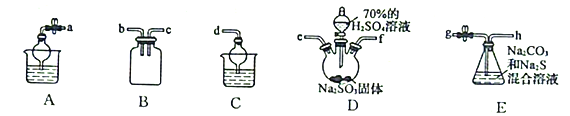
①从左到右连接各仪器,导管的接口顺序为:___________接e、f接___________、___________接___________、___________接d。___________
②E中发生反应的离子方程式为______________________。
③装置B的作用是______________________。
(4)操作1包括蒸发浓缩、______________________、___________、洗涤、干燥
(5)为测定产品Na2S2O3·5H2O的纯度,准确称取12.4gNa2S2O3·5H2O产品,配制成100mL溶液,取25.00mL溶液,以淀粉溶液作指示剂,用0.2500mol·L-1碘的标准溶液滴定,发生反应2S2O32-+I2= S4O62-+2I-,消耗碘的标准溶液20.00mL,则该产品的纯度为___________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com