
【题目】工业上以铬铁矿(主要成分是FeO·Cr2O3,含少量MgCO3、Al2O3、SiO2等)为原料制取铬酸钠(Na2CrO4)晶体,其工艺流程如下:

已知:①+3价Cr在酸性溶液中性质稳定,当pH>9时以CrO![]() 形式存在且易被氧化。
形式存在且易被氧化。
②常温下,部分阳离子以氢氧化物形式沉淀时溶液的pH如下:
阳离子 | Fe3+ | Fe2+ | Mg2+ | Al3+ | Cr3+ |
开始沉淀时的pH | 1.9 | 7.0 | 9.1 | — | — |
沉淀完全时的pH | 3.2 | 9.0 | 11.1 | 4.7(>10溶解) | 5.6(>9溶解) |
(1)提高酸浸速率的措施有__________________________________(答两条)。
(2)滤渣1的主要成分是_____;滤渣2的主要成分是_____;滤渣3的主要成分是_____。
(3)流程中两次使用了H2O2进行氧化,H2O2的电子式为___________;第一次氧化时反应的离子方程式为_____________________;第二次氧化时目的是____________________。
(4)流程图中“ ”内的操作是________________、洗涤、干燥。
(5)除去酸性废水中含有的Cr2O72-可以使用FeSO4,测得反应后的溶液中含Cr3+、Fe2+、Fe3+、H+等阳离子。该反应的离子方程式为_________________________________。
【答案】将铬铁矿粉碎,加热,适当提高硫酸的浓度,搅拌 SiO2 Fe(OH)3、Al(OH)3 Mg(OH)2 ![]() 2Fe2++H2O2+2H+ = 2Fe3++ 2H2O 将CrO2-氧化为CrO42- 蒸发浓缩、冷却结晶 6Fe2++Cr2O72-+14H+ = 6Fe3++ 2Cr3++7H2O
2Fe2++H2O2+2H+ = 2Fe3++ 2H2O 将CrO2-氧化为CrO42- 蒸发浓缩、冷却结晶 6Fe2++Cr2O72-+14H+ = 6Fe3++ 2Cr3++7H2O
【解析】
(1)提高酸浸速率的措施有将铬铁矿粉碎,加热,适当提高硫酸的浓度,搅拌。
(2) FeO·Cr2O3,MgCO3、Al2O3都与硫酸反应,SiO2不与硫酸反应,滤渣1的主要成分是SiO2;根据阳离子沉淀时的pH值,铁离子、铝离子沉淀,因此滤渣2的主要成分是Fe(OH)3、Al(OH)3;根据镁离子沉淀的pH值,得到滤渣3的主要成分是Mg(OH)2。
(3)流程中两次使用了H2O2进行氧化,H2O2的电子式为:![]() ;第一次氧化时主要是亚铁离子被双氧水氧化,其离子方程式为2Fe2++H2O2+2H+ = 2Fe3++ 2H2O;第二次氧化时主要是CrO2-被双氧水氧化,其目的是将CrO2-氧化为CrO42-。
;第一次氧化时主要是亚铁离子被双氧水氧化,其离子方程式为2Fe2++H2O2+2H+ = 2Fe3++ 2H2O;第二次氧化时主要是CrO2-被双氧水氧化,其目的是将CrO2-氧化为CrO42-。
(4)流程图中“ ”内的操作是蒸发浓缩、冷却结晶、洗涤、干燥。
(5)除去酸性废水中含有的Cr2O72-可以使用FeSO4,亚铁离子和重铬酸根反应生成铬离子和铁离子。
(1)提高酸浸速率的措施有将铬铁矿粉碎,加热,适当提高硫酸的浓度,搅拌,故答案为:将铬铁矿粉碎,加热,适当提高硫酸的浓度,搅拌。
(2) FeO·Cr2O3,MgCO3、Al2O3都与硫酸反应,SiO2不与硫酸反应,滤渣1的主要成分是SiO2;根据阳离子沉淀时的pH值,铁离子、铝离子沉淀,因此滤渣2的主要成分是Fe(OH)3、Al(OH)3;根据镁离子沉淀的pH值,得到滤渣3的主要成分是Mg(OH)2;故答案为:SiO2;Fe(OH)3、Al(OH)3;Mg(OH)2。
(3)流程中两次使用了H2O2进行氧化,H2O2的电子式为:![]() ;第一次氧化时主要是亚铁离子被双氧水氧化,其离子方程式为2Fe2++H2O2+2H+ = 2Fe3++ 2H2O;第二次氧化时主要是CrO2-被双氧水氧化,其目的是将CrO2-氧化为CrO42-,故答案为:
;第一次氧化时主要是亚铁离子被双氧水氧化,其离子方程式为2Fe2++H2O2+2H+ = 2Fe3++ 2H2O;第二次氧化时主要是CrO2-被双氧水氧化,其目的是将CrO2-氧化为CrO42-,故答案为:![]() ;2Fe2++H2O2+2H+ = 2Fe3++ 2H2O;将CrO2-氧化为CrO42-。
;2Fe2++H2O2+2H+ = 2Fe3++ 2H2O;将CrO2-氧化为CrO42-。
(4)从溶液中得到晶体,可以采用蒸发浓缩、冷却结晶的方法进行,因此流程图中“ ”内的操作是蒸发浓缩、冷却结晶、洗涤、干燥,故答案为:蒸发浓缩、冷却结晶。
(5)除去酸性废水中含有的Cr2O72-可以使用FeSO4,亚铁离子和重铬酸根反应生成铬离子和铁离子,其离子方程式为6Fe2++Cr2O72-+14H+ = 6Fe3++ 2Cr3++7H2O,故答案为:6Fe2++Cr2O72-+14H+ = 6Fe3++ 2Cr3++7H2O。


科目:高中化学 来源: 题型:
【题目】有机物A常用于食品行业,已知9.2 g A在足量的O2中充分燃烧,将生成的混合气体依次通过足量的浓硫酸和碱石灰,二者分别增重3.6g和8.8 g,经检验剩余气体为O2。
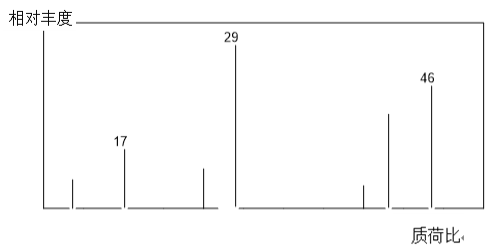
(1)有机物A的质谱图如下图所示,从图中可知其相对分子质量是___。
(2)A的结构简式为___。
(3)用A进行下列反应
①银镜反应:A在进行银镜反应之前必须在其中加入一定量的_______,因为_______。
②A发生银镜反应的化学方程式为_____________。
③写出A和乙醇反应的化学方程式___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,相同pH的盐酸和醋酸溶液分别加水稀释,pH随溶液体积变化的曲线如图所示。据图判断正确的是 ( )
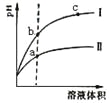
A.Ⅱ为盐酸稀释时pH变化曲线
B.a点Kw的数值比c点Kw的数值大
C.b点溶液的导电性比c点溶液的导电性强
D.b点酸的总浓度大于a点酸的总浓度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有前四周期T、X、Y、Z、W、M六种元素,已知W、Z、X、T、Y五种非金属元素原子半径依次减小,其中W原子的s电子总数等于p电子总数的2倍,M原子的M能层上有4个未成对电子。请回答下列问题:
(1)写出W、Z、X、T四种元素第一电离能由大到小的顺序:____________(用元素符号表示)。
(2)基态M原子的核外电子排布式为__________________________。
(3)根据VSEPR理论,推断出由W与X两元素组成的最简单二价阴离子的立体构型为____________,W原子的杂化类型为____________。
(4)Y与T、X、Z、W所形成的最简单化合物的沸点由高到低的顺序为__________________________(用化学式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,在容积恒定的密闭容器中,进行如下可逆反应:A(s)+B(g)![]() 2C(g),当下列物理量不发生变化时,能表明该反应已达到平衡状态的是( )
2C(g),当下列物理量不发生变化时,能表明该反应已达到平衡状态的是( )
①混合气体的密度 ②容器内气体的压强 ③混合气体的总物质的量 ④B物质的量浓度
A. ①②④ B. ②③ C. ②③④ D. 全部
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯苯是染料、医药、有机合成的中间体,是重要的有机化工产品。实验室制取氯苯如图所示(加热和固定仪器的装置略去)。
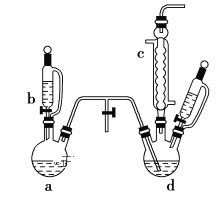
(1)a和b仪器组合成制取氯气的装置,反应无需加热,则a仪器中的固体反应物可以是__________;仪器c的名称是___________。
(2)把氯气通入反应器d中(d仪器中有FeCl3和苯),加热维持反应温度为40~60 ℃,温度过高会生成过多副产物的二氯苯。对d加热的方法是_____________。
(3)制取氯苯的化学方程式为_____________________________________________。
(4)仪器c出口的气体成分除了少量苯蒸气、水蒸气外,还有_________________。
(5) 仪器d中的反应完成后,工业上要进行水洗、碱洗及干燥。
①水洗的目的是除去混合物中混有的_____________________杂质。
②10% NaOH溶液碱洗是除去混合物中的_____________________。
(6)实验最后想要得到纯净氯苯的提纯方法是____________________。
(7)指出该实验装置的一个缺点__________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】1,2-二溴乙烷在常温下是无色液体,密度是2.18g/cm3,沸点是131.4℃,熔点是9.79℃,不溶于水,易溶于醇、丙酮等有机溶剂.在实验室可用如图所示装置来制备1,2-二溴乙烷.其中试管c中装有浓溴水.
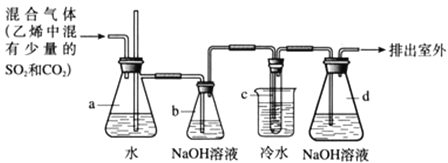
(1)写出制备1,2-二溴乙烷的化学方程式__________________________________;该反应属于______
反应(填反应类型);
(2)安全瓶a可以防止倒吸,并可以检查实验进行时试管c是否发生堵塞.如果发生堵塞,a中的现象是:____________________;
(3)容器b中NaOH溶液的作用是____________________;
(4)将试管c置于冷水中的目的是____________________;
(5)容器d中NaOH溶液的作用是____________________,所发生反应的离子方程式为
________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锗是第四周期第ⅣA族元素,锗是重要的半导体材料,用于制造晶体管及各种电子装置。下图为以锗锌矿(含GeO2、ZnS及少量Fe2O3)为原料生产高纯度锗的工艺流程如下:

已知:GeO2可溶于强碱溶液,生成锗酸盐。GeCl4的熔点为-49.5℃,沸点为84℃,在水中或酸的稀溶液中易水解。
回答下列问题:
(1)步骤①中提高碱浸效率的措施有______________________(写一种),NaOH溶液碱浸时发生反应的离子方程式为______________________。
(2)操作a的名称是___________,GeCl4的电子式为_______________。
(3)滤渣1中除含有ZnS外,还含有少量___________。滤渣2中除含有 CaGeO3外,还含有少量___________。
(4)步骤⑤中加入浓盐酸,发生反应的化学方程式为______________________。不用稀盐酸的原因是______________________。
(5)写出一种证明步骤⑧反应完全的操作方法:______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某反应由两步反应A→B、B→C构成,它的反应能量曲线如图所示(E1、E2、E3、E4表示活化能)。下列有关叙述正确的是

A. 两步反应均为吸热反应 B. 三种化合物中C最稳定
C. 加入催化剂会改变反应的焓变 D. 整个反应的ΔH=E1-E2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com