
【题目】单质硫在NaOH的热浓溶液中发生歧化反应,将2.56g硫与含0.0600molNaOH的热溶液反应恰好生成amolNa2Sx和bmolNa2S2O3,再加入1.00mol/L的NaClO溶液VmL,使溶液中所有硫元素全部转化为Na2SO4。计算:(1)a/b=________;
(2)V至少为___________。
【答案】![]()
![]()
【解析】
(1)通过S单质的物质的量计算出S和NaOH的物质的量之比,确定a与b的比值;
(2)根据得失电子守恒、原子守恒进行计算。
(1)2.56g硫与含0.0600molNaOH的热溶液反应恰好生成amolNa2Sx和bmolNa2S2O3,根据条件硫单质的物质的量为![]() =0.08mol,硫单质和氢氧化钠的物质的量之比为4:3,反应为
=0.08mol,硫单质和氢氧化钠的物质的量之比为4:3,反应为![]() ,所以a=0.02mol,b=0.01mol,因此a/b=2;
,所以a=0.02mol,b=0.01mol,因此a/b=2;
(2)加入1.00mol/L的NaClO溶液VmL,使溶液中所有硫元素全部转化为Na2SO4,硫元素守恒,所以可以看做硫单质全部变成了+6价,转移电子物质的量为0.48mol,次氯酸钠得电子,氯元素从+1价变为-1价,所以次氯酸钠的物质的量为0.24mol,所以V=240mL。


科目:高中化学 来源: 题型:
【题目】某二元酸(化学式用H2B表示)在水中的电离方程式是:H2B=H++HB-;HB-![]() H++B2-,回答下列问题:
H++B2-,回答下列问题:
(1)NaHB溶液显___(填“酸性”、“中性”或“碱性”或“无法确定”),理由是_______。
(2)某温度下,向0.1 mol·L-1 的NaHB溶液中滴入0.1 mol·L-1 KOH溶液至中性,此时溶液中以下关系一定正确的是________(填序号)。
a.c(H+)·c(OH-)=1×10-14 b.c(Na+)+c(K+)=c(HB-)+2c(B2-)
c.c(Na+)>c(K+) d.c(Na+)+c(K+)=0.05 mol·L-1
(3)已知0.1 mol·L-1NaHB溶液的pH=2,则0.1 mol·L-1H2B溶液中氢离子的物质的量浓度可能是________0.11 mol·L-1(填“<”、“>”或“=”); 理由是__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向葡萄酒中加入Na2S2O5抗氧化。测定某葡萄酒中Na2S2O5残留量的方法:取50.00ml葡萄酒样品,用0.0100molL-1的碘标准液滴定至终点,消耗标准液10.00ml。则该样品中Na2S2O5的残留量为![]() 已知
已知![]()
![]()
A.0.001gL-1B.0.002gL-1C.0.064gL-1D.0.19gL-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用下列实验装置(部分夹持装置略去)进行相应的实验,能达到实验目的的是 ( )
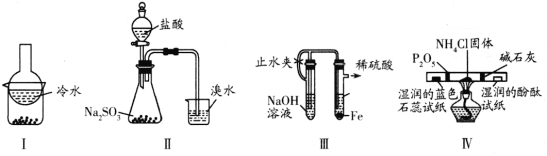
A. 加热装置I中的烧杯分离I2和高锰酸钾固体
B. 用装置II验证二氧化硫的漂白性
C. 用装置III制备氢氧化亚铁沉淀
D. 用装置IV检验氯化铵受热分解生成的两种气体
查看答案和解析>>
科目:高中化学 来源: 题型:
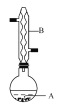
【题目】乙酸异戊酯是组成蜜蜂信息素的成分之一,具有香蕉的香味,实验室制备乙酸异戊酯的反应、装置示意图和有关数据如下:
![]() +
+![]()
![]()
![]() +H2O
+H2O
相对分子质量 | 密度/(g·cm-3) | 沸点/℃ | 水中溶解性 | |
异戊醇 | 88 | 0.812 3 | 131 | 微溶 |
乙酸 | 60 | 1.049 2 | 118 | 溶 |
乙酸异戊酯 | 130 | 0.867 0 | 142 | 难溶 |
实验步骤:
在A中加入4.4 g异戊醇、6.0 g乙酸、数滴浓硫酸和2~3片碎瓷片,开始缓慢加热A,回流50 min,反应液冷至室温后倒入分液漏斗中,分别用少量水、饱和碳酸氢钠溶液 和水 洗涤,分出的产物加入少量无水MgSO4固体,静置片刻,过滤除去MgSO4固体,进行蒸馏纯化,收集140~143℃馏分,得乙酸异戊酯3.9 g。回答下列问题:
(1)仪器B的名称是________,它的作用是____________________。
(2)在洗涤操作中,第一次水洗的主要目是___________________________
第二次水洗的主要目的是_______________________________________。
(3)在洗涤、分液操作中,应充分振荡,然后静置,待分层后____(填标号)。
a.直接将乙酸异戊酯从分液漏斗的上口倒出
b.直接将乙酸异戊酯从分液漏斗的下口放出
c.先将水层从分液漏斗的下口放出,再将乙酸异戊酯从下口放出
d.先将水层从分液漏斗的下口放出,再将乙酸异戊酯从上口倒出
(4)本实验中加入过量乙酸的目的是_____________________________。
(5)实验中加入少量无水MgSO4的目的是___________________________。
(6)在蒸馏操作中,仪器选择及安装都正确的是____(填标号)。
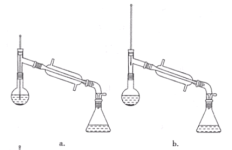
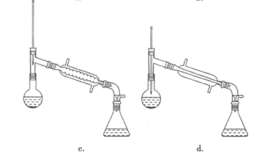
(7)本实验的产率是____(填标号)。
a.30% b.40% c. 60% d.90%
(8)在进行蒸馏操作时,若从130℃便开始收集馏分,会使实验的产率偏____(填“高”或“低”),其原因是____________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮和硫的化合物在工农业生产、生活中具有重要应用。请回答下列问题:
![]() 航天领域中常用
航天领域中常用![]() 作为火箭发射的助燃剂。
作为火箭发射的助燃剂。![]() 与氨气相似,是一种碱性气体,易溶于水,生成弱碱
与氨气相似,是一种碱性气体,易溶于水,生成弱碱![]() 用电离方程式表示
用电离方程式表示![]() 显碱性的原因是:________________。
显碱性的原因是:________________。
![]() 在恒温条件下,
在恒温条件下,![]() 和足量C发生反应
和足量C发生反应![]() ,测得平衡时
,测得平衡时![]() 和
和![]() 的物质的量浓度与平衡总压的关系如图所示:
的物质的量浓度与平衡总压的关系如图所示:
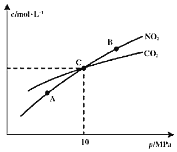
![]() 、B两点的浓度平衡常数关系:
、B两点的浓度平衡常数关系:![]() ______
______![]() 填“
填“![]() ”或“
”或“![]() ”或“
”或“![]() ”
”![]()
![]() 、B、C三点中
、B、C三点中![]() 的转化率最高的是______
的转化率最高的是______![]() 填“A”或“B”或“C”
填“A”或“B”或“C”![]() 点。
点。
![]() 计算C点时该反应的压强平衡常数
计算C点时该反应的压强平衡常数![]() ______
______![]() 是用平衡分压代替平衡浓度计算,分压
是用平衡分压代替平衡浓度计算,分压![]() 总压
总压![]() 物质的量分数
物质的量分数![]() 。
。
![]() 已知:亚硝酸
已知:亚硝酸![]() 性质和硝酸类似,但它是一种弱酸。常温下亚硝酸的电离平衡常数
性质和硝酸类似,但它是一种弱酸。常温下亚硝酸的电离平衡常数![]() ;
;![]() 的
的![]() ,
,![]() 在常温下向含有2mol碳酸钠的溶液中加入1mol的
在常温下向含有2mol碳酸钠的溶液中加入1mol的![]() 后,则溶液中
后,则溶液中![]() 、
、![]() 和
和![]() 的离子浓度由大到小的顺序是______。
的离子浓度由大到小的顺序是______。
![]() 已知:常温下甲胺
已知:常温下甲胺![]() 的电离常数为
的电离常数为![]() ,且
,且![]() 水溶液中有
水溶液中有![]() ,常温下向
,常温下向![]() 溶液滴加稀硫酸至
溶液滴加稀硫酸至![]() 时,则溶液
时,则溶液![]() ______。
______。
![]() 一种煤炭脱硫技术可以把硫元素以
一种煤炭脱硫技术可以把硫元素以![]() 的形成固定下来,但产生的CO又会与
的形成固定下来,但产生的CO又会与![]() 发生化学反应,相关的热化学方程式如下:
发生化学反应,相关的热化学方程式如下:![]()
![]()
![]() ,反应
,反应![]() ______
______![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.电离平衡常数可以表示弱电解质的相对强弱
B.电离平衡常数受溶液浓度的影响
C.H2CO3的电离常数表达式:K=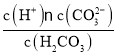
D.电离常数大的酸溶液中c(H+)一定比电离常数小的酸中大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某有机物结构简式为![]() ,下列叙述不正确的是( )
,下列叙述不正确的是( )
A.1mol该有机物在加热和催化剂作用下,最多能和4molH2反应
B.该有机物能使溴水褪色,也能使酸性KMnO4溶液褪色
C.该有机物在一定条件下能发生消去反应或取代反应
D.该有机物遇硝酸银溶液产生白色沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列化学方程式或离子方程式正确的是( )
A.用醋酸去除水垢:CaCO3+2H+=Ca2++H2O+CO2↑
B.甲醛与足量新制Cu(OH)2浊液反应:HCHO+2Cu(OH)2![]() HCOOH+Cu2O↓+2H2O
HCOOH+Cu2O↓+2H2O
C.实验室用液溴和苯在催化剂作用下制溴苯:![]() +Br2
+Br2![]()
![]() +HBr
+HBr
D.将CO2通入苯酚钠溶液:2![]() +CO2+H2O→2
+CO2+H2O→2![]() +Na2CO3
+Na2CO3
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com