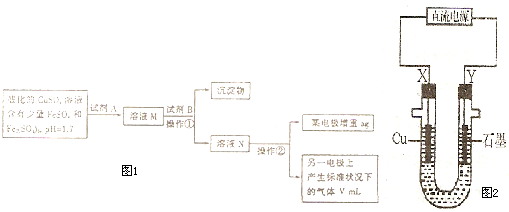
某学生拟用含有FeSO
4和 Fe
2(SO
4)
3的CuSO
4溶液提纯CuSO
4,并测定铜的相对原子质量,其实验流程如图1所示:

已知:
|
氢氧化物开始沉淀时的pH |
氢氧化物沉淀完全时的pH |
| Fe3+ |
1.9 |
3.2 |
| Fe2+ |
7.0 |
9.0 |
| Cu2+ |
4.7 |
6.7 |
| 供选择的试剂有:Cl2、H2O2、浓H2SO4、NOH、CuO、Cu |
试回答下列问题:
(1)试剂A的化学式为
H2O2
H2O2
,加入试剂A反应的离子方程式为
2Fe2++2H++H2O2=2Fe3++2H2O
2Fe2++2H++H2O2=2Fe3++2H2O
,试剂B的化学式为
CuO
CuO
,加入 B 的作用是
调节溶液的pH在3.2-4.7之间,使Fe3+完全水解为Fe(OH)3沉淀以便除去
调节溶液的pH在3.2-4.7之间,使Fe3+完全水解为Fe(OH)3沉淀以便除去
,操作①的名称是
过滤
过滤
.
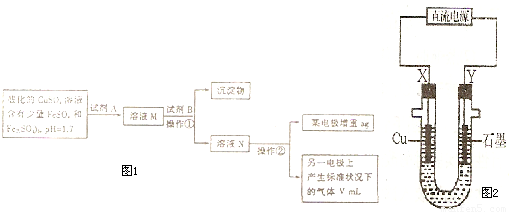
(2)操作②中所用仪器装置如图2所示:则 X 应接直流电源的
负
负
极,Y电极上发生的电极反应式为:
4OH--4e-=2H2O+O2↑
4OH--4e-=2H2O+O2↑
.
(3)下列实验操作必要的是
A、B、D、E
A、B、D、E
(填字母).
A.称量电解前电极的质量
B.电解后电极在烘干前,必须用蒸馏水冲洗
C.刮下电解后电极上的铜,并清洗、称量
D.电极的烘干称重的操作中必须按:烘干→称重→再烘干→再称重进行两次
E.在空气中烘干电极,必须采用低温烘干法
(4)向电解后的溶液中加入石态溶液,观察到的现象是
溶液变为红色
溶液变为红色
.
(5)铜的相对原子质量的计算式为
.




 已知在pH为4~5的溶液中,Cu2+几乎不水解,而Fe3+几乎完全水解.某学生拟用电解CuSO4溶液的方法测定铜的相对原子质量.该同学向pH=3.8酸化的、含有Fe2(SO4)3杂质的CuSO4溶液中加入过量的黑色粉末X,充分搅拌后将滤液用下图所示装置电解,其中某电极增重a g,另一电极上产生标准状况下的气体VmL.下列说法正确的是( )
已知在pH为4~5的溶液中,Cu2+几乎不水解,而Fe3+几乎完全水解.某学生拟用电解CuSO4溶液的方法测定铜的相对原子质量.该同学向pH=3.8酸化的、含有Fe2(SO4)3杂质的CuSO4溶液中加入过量的黑色粉末X,充分搅拌后将滤液用下图所示装置电解,其中某电极增重a g,另一电极上产生标准状况下的气体VmL.下列说法正确的是( )