
| A. | ①②③ | B. | ①②④ | C. | ①③④ | D. | ②③④ |
分析 根据电池的总反应:Fe+Ni2O3+3H2O=Fe(OH)2+2Ni(OH)2,可以判断出铁镍蓄电池放电时Fe作负极,发生氧化反应,为还原剂,失电子生成Fe2+,最终生成Fe(OH)2,Ni2O3作正极,发生还原反应,为氧化剂,得电子,最终生成Ni(OH)2,电池放电时,负极反应为Fe+2OH--2e-=Fe(OH)2,则充电时,阴极发生Fe(OH)2+2e-=Fe+2OH-,阴极附近溶液的pH升高,电池充电时,阳极发生2Ni(OH)2+2OH--2e-=Ni2O3+3H2O.
解答 解:①由放电时的反应可以得出铁做还原剂失去电子,Ni2O3做氧化剂得到电子,即正极为Ni2O3、负极为Fe,故①错误;
②充电可以看作是放电的逆过程,即阴极为原来的负极,所以电池放电时,负极反应为:Fe+2OH--2e-=Fe(OH)2,所以电池充电过程时阴极反应为Fe(OH)2+2e-=Fe+2OH-,故②正确;
③充电时,阴极发生Fe(OH)2+2e-=Fe+2OH-,阳极发生2Ni(OH)2+2OH--2e-=Ni2O3+3H2O,Ni(OH)2做阳极,故③正确.
④根据总反应Fe+Ni2O3+3H2O=Fe(OH)2+2Ni(OH)2,可以判断出铁镍蓄电池放电时Fe作负极,发生氧化反应,为还原剂,失电子生成Fe2+,碱性电解质中最终生成Fe(OH)2,所以电解质溶液是碱,故④正确;
故选D.
点评 本题考查二次电池的工作原理,涉及到原电池和电解池的有关知识,做题时注意根据总反应从氧化还原的角度判断化合价的变化,以得出电池的正负极以及所发生的反应,题目难度中等.


科目:高中化学 来源: 题型:解答题




查看答案和解析>>
科目:高中化学 来源: 题型:选择题
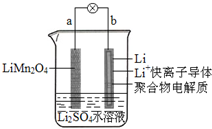 2013年3月我国科学家报道了如图所示的水溶液锂离子电池体系.下列叙述错误的是( )
2013年3月我国科学家报道了如图所示的水溶液锂离子电池体系.下列叙述错误的是( )| A. | a为电池的正极 | |
| B. | 电池放电反应为LiMn2O4=Li1-xMn2O4+xLi | |
| C. | 放电时,a极锂的化合价不发生变化 | |
| D. | 放电时,溶液中的Li+从b向a迁移 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. |  | B. | 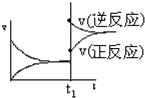 | C. | 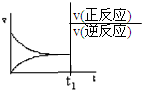 | D. | 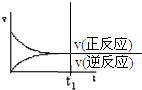 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 温度/℃ | n(活性炭)/mol | n(CO2)/mol |
| T1 | 0.70 | |
| T2 | 0.25 |
| A. | 上述信息可推知:T1<T2 | |
| B. | T1℃时,该反应的平衡常数K=$\frac{9}{16}$ | |
| C. | T1℃时,若开始时反应物的用量均减小一半,平衡后NO的转化率减小 | |
| D. | T2℃时,若反应达平衡后再缩小容器的体积,c(N2):c(NO)不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| NaCl | KCl | MgO | AlCl3 | SiC | 晶体B | CCl4 | CBr | |
| 熔点/℃ | 801 | 772 | 2800 | 190 | 2600 | 2300 | -22.9 | 90 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

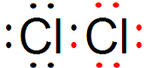
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
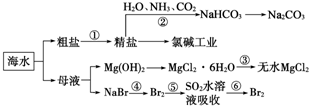
| A. | 过程①中除去粗盐中的SO${\;}_{4}^{2-}$、Ca2+、Mg2+、Fe3+等杂质,加入的药品顺序为:Na2CO3溶液→NaOH溶液→BaCl2溶液→过滤后加盐酸 | |
| B. | 过程②中应先通入NH3再通入CO2气体 | |
| C. | 过程③中结晶出的MgCl2•6H2O要在HCl氛围中加热脱水制得无水MgCl2 | |
| D. | 从第⑤~⑥步的目的是浓缩、富集溴单质 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com