
| NaCl | KCl | MgO | AlCl3 | SiC | 晶体B | CCl4 | CBr | |
| 熔点/℃ | 801 | 772 | 2800 | 190 | 2600 | 2300 | -22.9 | 90 |
分析 (1)氧化镁是离子晶体;氯化铝的熔点低是分子晶体;晶体B的熔点高是原子晶体;四氯化碳的熔点低是分子晶体;
(2)NaCl的熔点高于KCl,所以NaCl的晶格能大于KCl的晶格能;离子化合物中晶格能越大,离子所带电荷越多,熔沸点越高;
(3)CBr4分子中的碳是sp3杂化,所以分子的空间构型是正四面体结构;CBr4和CCl4都是分子晶体,相对分子量越大,熔点越高.
解答 解:(1)氧化镁是离子晶体;氯化铝的熔点低是分子晶体;晶体B的熔点高是原子晶体;四氯化碳的熔点低是分子晶体,故答案为:离子晶体;分子晶体;原子晶体;分子晶体;
(2)NaCl的熔点高于KCl,所以NaCl的晶格能大于KCl的晶格能;MgO中离子都带2个单位电荷,NaCl中离子都带1个单位电荷,离子半径Cl-<O2-,Mg2+<Na+,高价化合物的晶格能远大于低价离子化合物的晶格,晶格能MgO>NaCl,故熔点MgO>NaCl,故答案为:大于;电荷数多,晶格能大;
(3)CBr4分子中的碳是sp3杂化,所以分子的空间构型是正四面体结构;CBr4和CCl4都是分子晶体,相对分子量越大,熔点越高,CBr4的相对分子质量大于CCl4的相对分子质量,故答案为:正四面体;CBr4的相对分子质量大于CCl4的相对分子质量,所以CBr4的熔点大于CCl4熔点.
点评 本题涉及的知识点有:根据晶体的物理性质确定晶体的类型、晶格能、分子的空间构型和分子间作用力,综合性强,但难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 25℃,$\frac{{K}_{W}}{c({H}^{+})}$=0.1mol/L的溶液中:ClO-、Cl-、K+、HSO3- | |
| B. | 无色强酸性溶液中:Na+、Cl-、SO42-、[Cu(NH3)4]2+ | |
| C. | 水电离产生的c(H+)=10-13 mol•L-1的溶液中:Na+、Cl-、NO3-、SO42- | |
| D. | 加入Al能放出H2的溶液中:NH4+,SO42-,Br-,NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③ | B. | ①②④ | C. | ①③④ | D. | ②③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
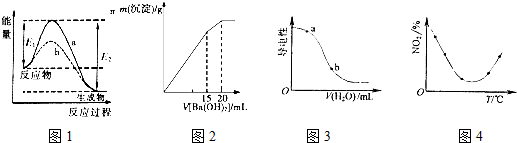
| A. | 图1表示某放热反应在无催化剂(a)和有催化剂(b)时反应的能量变化,且加入催化剂改变反应的焓变 | |
| B. | 图2表示某明矾溶液中加入Ba(OH)2溶液,沉淀的质量与加入Ba(OH)2溶液体积的关系,在加入20 mL Ba(OH)2溶液时铝离子恰好沉淀完全 | |
| C. | 图3表示在CH3COOH溶液中加水时溶液的导电性变化,则CH3COOH溶液的pH:a>b | |
| D. | 图4表示等量NO2在容积相同的恒容密闭容器中,不同温度下分别发生反应:2NO2(g)?N2O4(g),相同时间后测得NO2含量的曲线,则该反应的△H<0 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③④ | B. | ④①②③ | C. | ②①③④ | D. | ④③②① |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com