
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:推断题
| 编号 | 性质推测 | 化学方程式 |
| 示例 | 氧化性 | H2EO3+4HI═Z↓+2I2+3H2O |
| 1 | ||
| 2 |
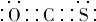 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③④⑤⑦ | B. | ②③⑤⑥ | C. | ①③④⑤⑥ | D. | ③④⑤⑥⑦ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
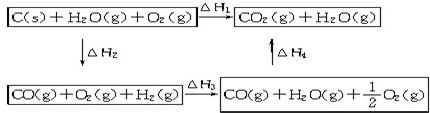
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 问题 | 实验步骤 | 实验现象 | 结论 | |
实验一 | 存在有色离子吗? | 取少量粉末,加水,溶解,过滤 | 有白色沉淀生成,滤液无色 | 这种粉末中一定无FeCl3 |
实验二 | 白色沉淀是什么? | 取少量沉淀,向其中滴加稀盐酸 | 沉淀部分溶解有气泡产生 | 有硫酸钠、碳酸钠、硝酸钡 |
实验三 | 是否含有KCl? | 取少量滤液,滴加硝酸银溶液和稀硝酸 | 产生白色沉淀 | 有KCl存在 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
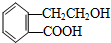 ,它可通过不同化学反应分别制得B、C、D和E四种物质.
,它可通过不同化学反应分别制得B、C、D和E四种物质.
 ;
;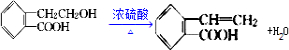 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 4个-CH3,能生成4种一氯取代物 | B. | 3个-CH3,能生成3种一氯取代物 | ||
| C. | 3个-CH3,能生成4种一氯取代物 | D. | 2个-CH3,能生成4种一氯取代物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 石油分馏可获得乙烯、丙烯和丁二烯 | |
| B. | 盐析可提纯蛋白质并保持其生理活性 | |
| C. | 从煤焦油中可分离出苯、甲苯及二甲苯 | |
| D. | 锂具有还原性、导电性和比能量高,可用作锂电池的负极材料 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com