
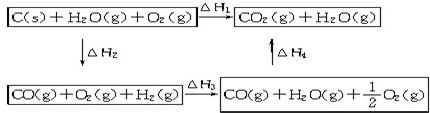
分析 (1)先根据燃烧热写出热化学方程式,然后根据盖斯定律来解答;
(2)依据热化学方程式分析判断反应放出的热量;
根据盖斯定律:化学反应不管是一步完成还是分几步完成,其反应热是相同的;也就是说,化学反应的反应热只与反应的始态和终态有关,与反应途径无关.即如果一个反应可以分几步进行,则各步反应的反应热之和与该反应一步完成时的反应热相同;
根据煤转化为水煤气要吸收热量分析.
解答 解:(1)①C(s)+O2(g)=CO2(g)△H=-393.5 kJ/mol,
②H2(g)+$\frac{1}{2}$O2(g)═H2O(g)△H2=-242.0kJ•mol-1,
③CO(g)+$\frac{1}{2}$O2(g)═CO2(g)△H3=-283.0kJ•mol-1,
根据盖斯定律,①-②-③得:C(s)+H2O(g)=CO(g)+H2(g)△H=+131.5kJ/mol,
故答案为:C(s)+H2O(g)=CO(g)+H2(g)△H=+131.5kJ/mol;
(2)①C(s)+O2(g)=CO2(g)△H1=-393.5kJ•mol-1;
②H2(g)+$\frac{1}{2}$O2(g)═H2O(g)△H2=-242.0kJ•mol-1,
③CO(g)+$\frac{1}{2}$O2(g)═CO2(g)△H3=-283.0kJ•mol-1,
比较反应热数据可知,1molCO(g)和1molH2(g)完全燃烧放出的热量之和,比1molC(s)完全燃烧放出的热量多,
化学反应不管是一步完成还是分几步完成,其反应热是相同的;也就是说,化学反应的反应热只与反应的始态和终态有关,与反应途径无关.即如果一个反应可以分几步进行,则各步反应的反应热之和与该反应一步完成时的反应热相同;
△H1、△H2、△H3、△H4之间存在的关系式为:△H1=△H2+△H3+△H4;
依据盖斯定律可知,将煤转化为水煤气再燃烧放出的热量,最多与直接燃烧煤放出的热量相同,乙正确;
煤转化为水煤气要吸收热量,煤炭燃烧时加少量水,结合盖斯定律可知,煤炭燃烧放出相同的热量;
故答案为:多;△H1=△H2+△H3+△H4;乙;甲同学忽略了煤转化为水煤气要吸收热量.
点评 本题主要考查了热化学方程式书写和计算,盖斯定律的应用分析,掌握基础是关键,题目较简单.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
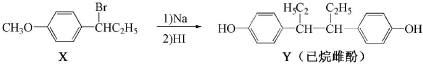
| A. | 在NaOH水溶液中加热,化合物X可发生消去反应 | |
| B. | 在一定条件,化合物Y可与HCHO发生缩聚反应 | |
| C. | 用FeCl3溶液可鉴别化合物X和Y | |
| D. | 化合物Y能使酸性高锰酸钾溶液褪色 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
| 元素 | 相关信息 |
| X | X的一种单质是自然界硬度最大的晶体 |
| Y | Y的基态原子最外层电子排布式为nsnnpn+1 |
| Z | Z的基态原子L层电子数是K层电子数的3倍 |
| W | W的一种核素的质量数为58,中子数为32 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
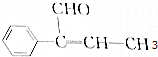 ,下列关于A的叙述中错误的是( )
,下列关于A的叙述中错误的是( )| A. | 在加热和催化剂作用下,能被氢气还原 | |
| B. | 能被高锰酸钾酸性溶液氧化 | |
| C. | 在一定条件下能与溴发生取代反应 | |
| D. | 不能与氢溴酸发生加成反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
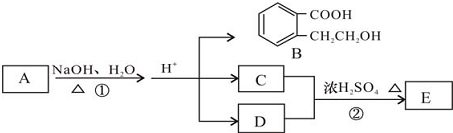
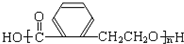 .
.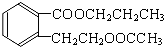 +2 NaOH$\stackrel{△}{→}$
+2 NaOH$\stackrel{△}{→}$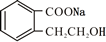 +CH3COONa+CH3CH2CH2OH.
+CH3COONa+CH3CH2CH2OH.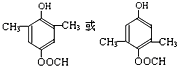 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

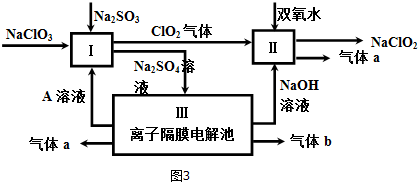
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
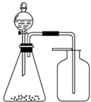
| A. | 浓氨水与固体CaO制氨气 | B. | 盐酸与CaCO3固体制CO2 | ||
| C. | 稀硝酸与铜片制NO | D. | 饱和食盐水与电石制乙炔 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com