
����Ŀ��л���ն��Σ�Cu2SO3��CuSO3��2H2O)��һ�ֲ�����ˮ������Ҵ��Ĺ��壬100��ʱ�����ֽ⡣����CuSO4��5H2O��SO2��Ϊԭ���Ʊ���ʵ��װ�D����ͼ��ʾ��
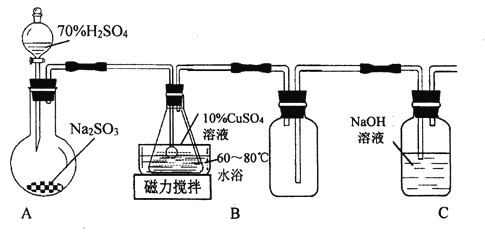
(1)װ��A�ڳ�������ȡSO2ʱ����70%���������ϡ�����98%Ũ���ᣬ��ԭ����________��
(2)װ��B�з�����Ӧ�����ӷ���ʽΪ_________��
(3)װ��C��������__________��
(4)��B�л�õĹ�������������ˮ���ϴ�ӣ�����ո�����鼺ϴ����ȫ�ķ�����________________��
(5)�벹�������ɹ�ҵ������ͭ��������FeO)�Ʊ�ʵ��ԭ�ϣ�����CuSO4��5H2O) ��ʵ�鷽������ҵ������ͭ�б߽�������Թ�����������Һ����ʹ����ȫ�ܽ⣬�߽���������е���______��Һ�������������________����3.2<pH<4.2�����ã����ˣ�����Һˮԡ��������Ũ����������־�Ĥ����ȴ�ᾧ�����ˣ���95% �ƾ�ϴ�Ӿ���2��3�Σ����ɣ��õ�CuSO4��5H2O��
[��֪������Һ���������↑ʼ�����������ȫʱ��pH��Χ�ֱ�Ϊ��Fe(OH)2 (5.8, 8.8); Cu(OH)2 (4.2, 6.7); Fe(OH)3 (1.1��3.2)]
���𰸡� ����������ϡ�����е��ܽ��̫��Ũ������H+Ũ��С���������Ʊ��������� 3Cu2++3SO2+6H2O= Cu2SO3��CuSO3��2H2O+8H++SO42- ����ȫƿ����ֹ���� ȡ�������һ�εĹ���Һ���Թ��У������еμ������ữ��BaCl2��Һ������������ɫ�������������ϴ����ȫ H2O2 CuO[�� Cu(OH)2 �� CuCO3�� Cu2(OH)2 CO3]
��������װ��A��Ũ��������������Ʊ�����������60����80�������£�������ͭ��Һ��װ��B�з�Ӧ����л���ն���(Cu2SO3CuSO32H2O)��Dװ����������δ��Ӧ��Ķ��������ж����壬��ֹ��Ⱦ������
(1)��������������ˮ����ϡ�����е��ܽ��̫��Ũ������H+Ũ��̫С���������Ʊ�����������70%���Ậˮ���٣�������ˮ�������ڶ��������������ʴ�Ϊ������������ϡ�����е��ܽ��̫��Ũ������H+Ũ��С���������Ʊ���������
(2)װ��B�з�������ͭ������������ɲ���Cu2SO3CuSO32H2O�ķ�Ӧ��ͭԪ�ػ��ϼ۽��͵�+1�ۣ��������������Ԫ�����۵�+6�ۣ���Ӧ�����ӷ���ʽΪ��3Cu2++3SO2+6H2O=Cu2SO3CuSO32H2O��+8H++SO42-���ʴ�Ϊ��3Cu2++3SO2+6H2O=Cu2SO3CuSO32H2O��+8H++SO42-��
(3)��������������ˮ��װ��C���Է��������ʴ�Ϊ������ȫƿ����ֹ������
(4)�ٲ�����δϴ�Ӹɾ�������溬����������ӣ�������������Ӽ��ɣ�������������ӵķ���Ϊ��ȡ�������һ�ε�ϴ�ӹ���Һ���Թ��У������еμ������ữ��BaCl2��Һ������������ɫ�����������������ϴ����ȫ���ʴ�Ϊ��ȡ�������һ�εĹ���Һ���Թ��У������еμ������ữ��BaCl2��Һ������������ɫ�������������ϴ����ȫ��
(5)�ɹ�ҵ������ͭ(������FeO)�Ʊ�ʵ��ԭ��(����CuSO45H2O)����ҵ������ͭ�б߽�������Թ�����������Һ����ʹ����ȫ�ܽ⣬�õ�����ͭ�����������Ļ����Һ���轫�������ӳ�ȥ��������Ŀ����Ϣ�����������Գ�����ʽ��ȥʱͭ��������ʧ������������ȫ����ʱ��ͭ��������ʧ����Ӧ�Ƚ�������������Ϊ�����ӣ����Dz����������ʣ�Ӧѡ��˫��ˮ���ٵ���pH�������ӳ������ʲ���Ϊ����ҵ������ͭ�б߽�������Թ�����������Һ����ʹ����ȫ�ܽ⣬�߽���������е���H2O2��Һ����������������CuO[��Cu(OH)2�� CuCO3�� Cu2(OH)2 CO3]����3.2��pH��4.2�����ã����ˣ�����Һˮԡ����������Ũ����������־�Ĥ����ȴ�ᾧ�����ˣ���95%�ƾ�ϴ�Ӿ���2��3�Σ����ɣ��õ�CuSO45H2O���ʴ�Ϊ��H2O2��CuO[��Cu(OH)2�� CuCO3�� Cu2(OH)2 CO3]��


 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����������к��зǼ��Թ��ۼ�����
A. NaOH B. Na2O C. Na2O2 D. CaCl2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ijԪ�ص�ԭ������������ֻ��2������Ԫ��( )
A.һ���Ǣ�A��Ԫ��B.һ���ǽ���Ԫ��
C.�����ǽ���Ԫ�أ�Ҳ���ܲ���D.һ���Ƿǽ���Ԫ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪X��Y��Z��������Ԫ�������ڱ��е����λ����ͼ��ʾ����X��ԭ������Ϊa������˵���в���ȷ���ǣ� �� 
A.Y��Z��ԭ������֮�Ϳ�����2a
B.Y��ԭ������������a��17
C.Z��ԭ������������a+31
D.X��Y��Zһ�����Ƕ�����Ԫ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij��ѧ��ȤС��Ϊ̽��Ԫ�����ʵĵݱ���ɣ���ƿ�����ϵ��ʵ�飮
��1���ٽ��ơ��ء�þ������1mol�ֱ�Ͷ�뵽������0.1molL��1�������У�д�������ᷴӦ�����Ľ���������Ӧ�����ӷ���ʽ ��
�ڽ�NaOH��Һ��NH4Cl��Һ�������NH3H2O���Ӷ���֤NaOH�ļ��Դ���NH3H2O���̶�������֤Na�Ľ����Դ���N������Ϊ������Ƿ��������˵�����ɣ� ��
��2��������ͼװ�ÿ�����֤�ǽ����Եı仯���ɣ� 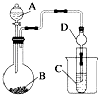
��ʵ�������ṩҩƷNa2S��MnO2��Ũ���ᡢKMnO4 �� ��Ҫ֤���ǽ�����Cl��S��װ��A��B��C����װҩƷ�ֱ�Ϊ �� װ��C�е�ʵ������Ϊ�е���ɫ�������ɣ����ӷ���ʽΪ ��
����Ҫ֤���ǽ����ԣ�C��Si����A�м���B�м�Na2CO3��C�м�Na2SiO3 �� ��۲�װ��C�е�ʵ������Ϊ�а�ɫ�������ɣ����ӷ���ʽΪ �� ��������ͨ�����ǹ����ģ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ѧ������������ء�����˵��������� ( )
A.��ˮ����һ�ֹ��ϵ��̻�����������������װ��������������ɷ��ڵ���֭�����������������Ҫ�ɷ��ǹ�����
B.Һ�������������������Һ����������
C.����Ϫ��̸������ȡ������֮���������Ҳ��������������ӡ����������۵�ȴ�����
D.��Ϊ����һ���콢оƬ����9905G�а뵼�����Ϊ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����и���ʵ�鲻��ˮԡ���ȵ��ǣ� ��
A.��������B.���屽C.������ӦD.����������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���±���Ԫ�����ڱ���һ���֣��������е���ĸ�ֱ����һ�ֻ�ѧԪ�ء�

�Իش��������⣺
(1)��д��Ԫ��M�Ļ�̬ԭ�ӵļ۵����Ų�ʽ��________________________��
(2)��״���£�11.2L AC2������������ĿΪ______��д��AC2�ĵ���ʽ��_________________��
(3)E��F��G�ĵ�һ�������ɴ�С��˳��Ϊ��____________������Ԫ�ط��ţ�
(4)LC2I2������Ϊ���ɫҺ�壬���� CCl4��CS2 �Ȼ��ܣ��ݴ˿��ж� LC2I2��________(���������������Ǽ�����)���ӡ�
(5)�ڢٱ�����CH3OH����CS2����C2H4����CCl4���������У�̼ԭ�Ӳ�ȡsp2�ӻ��ķ�����________(�����)��
(6)Ԫ��N�����γɷ���ʽΪCo��NH3��5BrSO4����λ����Ϊ6������������������һ����������Һ�м���BaCl2��Һʱ������������������AgNO3��Һʱ����������ɫ��������������Ļ�ѧʽΪ_______________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����з�Ӧ����������ԭ��Ӧ���������ȷ�Ӧ����( )
A. ���ȵ�̿��CO2��Ӧ B. Ba(OH)2��8H2O��NH4Cl��Ӧ
C. ��Ƭ��ϡH2SO4��Ӧ D. ������O2�е�ȼ�շ�Ӧ
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com