
【题目】Se是迄今为止发现的最重要的抗衰老元素,也有抗癌之王的美誉。回答下列问题:
(1)基态Se原子核外电子占据的轨道中,电子云轮廓图形状为哑铃形的有 _____个;第四周期的过渡金属中,基态原子核外未成对电子数与基态Se原子相同的有____种。
(2)Se及其同周期相邻元素相比,三种元素的基态原子的第一电离能由大到小的顺序为____。
(3) H2Se属于____(填“极性”或“非极性”)分子;其熔点低于同条件下NaH熔点的原因为______。
(4) SeO2的立体构型为____。SeO3中Se原子的杂化形式为____。
(5)写出一种与SeO42-互为等电子体的分子式____.
(6)Se能与 形成具有多种生物活性的配合物。1mol
形成具有多种生物活性的配合物。1mol 中含有σ键的数目为 ___。
中含有σ键的数目为 ___。
(7)硒化锌是一种重要的半导体材料,其立方晶胞结构如图所示。若晶胞参数为apm,阿伏加德罗常数的值为NA晶体密度为ρ g·cm-3,则硒化锌的摩尔质量可表示为 ___。(列出计算式即可)

【答案】9 2 Br>As>Se 极性 H2Se形成的晶体属于分子晶体,NaH形成的晶体为离子晶体 V形 sp2 CX4、SiX4(X代表卤原子)等中的一种 34 NA ![]() g/mol
g/mol
【解析】
(1)Se的原子序数为34,位于元素周期表第四周期VIA族,其所有能层的p能级电子云轮廓图形状均为哑铃形;基态原子核外价电子排布式为4s24p4,其未成对电子数为2,据此作答;
(2)同周期中,元素的第一电离能呈增大趋势,IIA与VA族元素最外层电子排布处于全充满和半充满状态,所以会比同周期后一族元素的第一电离能大;
(3)H2Se属于分子化合物,从键的极性与分子的立体构型判断分子的极性;熔沸点的大小可以从物质所属的晶体类型分析判断,一般情况下,分子晶体的熔沸点低于离子晶体的熔沸点;
(4)依据价层电子对互斥理论和杂化轨道理论分析作答;
(5)等电子体是指原子总数相同,价层电子总数相同的分子或离子;可通过相邻元素或相邻族的元素替换并调整电荷数来寻找等电子体;
(6)在该化合物中,一个苯环中含6个C-Cσ键和6个C-Hσ键,一个单键或双键中分别含1个σ键,据此计算;
(7)根据硒化锌晶胞结构图可知,每个锌原子周围有4个硒原子,每个硒原子周围也有4个锌原子,该晶胞中含有硒原子数为8×![]() +6×
+6×![]() = 4,含有锌原子数为4,根据ρ=
= 4,含有锌原子数为4,根据ρ= ![]() 可计算出晶胞的质量,进而确定其摩尔质量;
可计算出晶胞的质量,进而确定其摩尔质量;
(1)Se的原子序数为34,其基态原子核外电子排布式为1s22s22p63s23p63d104s24p4,因各能层的p能级原子轨道数有3个,所以基态Se原子核外电子占据的轨道中,电子云轮廓图形状为哑铃形的有3+3+3 = 9个,因为基态Se原子核外价电子排布式为4s24p4,电子未成对电子数为2,在第四周期过渡金属中,基态原子核外未成对电子数为2的有Ti和Ni共2种元素,
故答案为:9;2;
(2)与Se同周期相邻的元素为第VA族的As和第VIIA的Br元素,因周期中,第一电离能虽原子序数的增加呈增大趋势,则Br的第一电离能最大,又因为As处于第VA族,核外电子排布4p能级处于半充满状态,稳定结构,故其第一电离能比Se的大,所以三者第一电离能从大到小顺序为:Br>As>Se,
故答案为:Br>As>Se;
(2)H2Se分子内为极性共价键,根据价层电子对互斥理论可知,该分子价层电子对数为4,有2对孤电子对,则其分子的立体构型为V形,极性键的极性向量和不等于零,所以该分子为极性分子,又因为NaH形成的晶体为离子晶体,而H2Se形成的晶体属于分子晶体,所以其熔沸点较NaH低,
故答案为:H2Se形成的晶体属于分子晶体,NaH形成的晶体为离子晶体;
(4)根据价层电子对互斥理论可知,SeO2的Se的孤电子对数为2,![]() 键电子对数为2,所以价层电子对数 = 2+2 =4,其分子的VSEPR模型为四面体形,分子的空间立体构型为V形,SeO3中Se原子的杂化轨道数 = 3+0= 3,所以采用的杂化方式为sp2,
键电子对数为2,所以价层电子对数 = 2+2 =4,其分子的VSEPR模型为四面体形,分子的空间立体构型为V形,SeO3中Se原子的杂化轨道数 = 3+0= 3,所以采用的杂化方式为sp2,
故答案为:V形;sp2;
(5)SeO42-的原子总数为5,价层电子总数为6+6×4+2 = 32,与SeO42-互为等电子体的分子可以是CX4、SiX4(X代表卤原子)等中的一种,
故答案为:CX4、SiX4(X代表卤原子)等中的一种;
(6)根据上述分析可知,1 mol 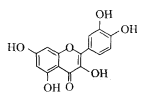 分子中σ键数目等于共价键数,所以σ键数目总数 = 2×12 mol(苯环上) + 5×1 mol(酚羟基) +5×1 mol(杂环)= 34 mol,
分子中σ键数目等于共价键数,所以σ键数目总数 = 2×12 mol(苯环上) + 5×1 mol(酚羟基) +5×1 mol(杂环)= 34 mol,
故答案为:34 NA;
(7)设硒化锌的摩尔质量为M,该晶胞中该晶胞中含有硒原子数为8×![]() +6×
+6×![]() = 4,含有锌原子数为4,其化学式可表示为ZnSe,根据晶胞中ρ=
= 4,含有锌原子数为4,其化学式可表示为ZnSe,根据晶胞中ρ= ![]() 可得,ρ=
可得,ρ= ![]() ,化简整理得 M=
,化简整理得 M= ![]() g/mol,
g/mol,
故答案为:![]() g/mol。
g/mol。


 黎明文化寒假作业系列答案
黎明文化寒假作业系列答案科目:高中化学 来源: 题型:
【题目】某兴趣小组采用如下方法制作氢氧燃料电池。
(1)如图A所示:a, b均为多孔石墨棒,其中a与直流电源正极相连,b与直流电源负极相连,电解质溶液为NaOH,则图A 中a极称为_______极 (填电极名称)其电极反应式分别为:_____电解总反应化学方程式为 ___________________。(由于使用多孔石墨棒,此时生成的氢气及氧气中有一部分被石墨棒吸附。)

(2)然后如图B所示,移走直流电源,在a, b极间连接一个小灯炮,可以看到灯泡发光。此时的电流方向是 ___________,(填“a→b”或“b→a”)此时a极称为___________(填电极名称)其电极反应式为______________,b极的电极反应式为____________

(3)若图B中氢氧燃料电池改成甲烷燃料电池则b中电极反应式为______________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】MoS2(辉钼矿的主要成分)可用于制取钼的化合物润滑添加剂氢化反应和异构化反应的催化剂等。回答下列问题:
(1)反应3MoS2+18HNO3+12HCl=3H2[MoO2Cl4]+18NO↑+6H2SO4+6H2O中,每溶解1mol MoS2,转移电子的物质的量为___________。
(2)已知:MoS2(s)= Mo(s)+S2(g) △H1
S2(g)+2O2(g)=2SO2(g) △H2
2MoS(s)+7O2(g)=2MoO3 (s)+4SO2(g) △H3
反应2Mo(s)+3O2(g)=2MoO3(s)的△H=___________(用含△H1、△H2、△H3的代数式表示)。
(3)利用电解法可浸取辉钼矿得到Na2MoO4和Na2SO4溶液(装置如图所示)。

①阴极的电极反应式为______________________。
②一段时间后,电解液的pH___________ (填“增大”“减小”或“不变”),MoO42-在电极___________(填“A”或“B”)附近生成。
③实际生产中,惰性电极A一般不选用石墨,而采用DSA惰性阳极(基层为TiO2,涂层为RuO2+IrO2),理由是_______________________。
(4)用辉钼矿冶炼Mo的反应为
MoS2(s)+4H2(g)+2Na2CO3(s)![]() Mo(s)+2CO(g)+4H2O(g)+2Na2S(s) △H。
Mo(s)+2CO(g)+4H2O(g)+2Na2S(s) △H。
①该反应的△H___________(填“>”或“<”)0;p1、p2、p3按从小到大的顺序为___________。
②在某恒容密闭容器中加入0.1 mol MoS2、0.2mol Na2CO3、0.4mol H2,一定温度下发生上述反应,下列叙述说明反应已达到平衡状态的是____________ (填标号)。
a.v正(H2)=v逆(CO)
b.气体的密度不再随时间变化
c.气体的压强不再随时间变化
d单位时间内断裂H一H键与断裂H—O键的数目相等
③在2L的恒温恒容密闭容器中加入0.1 mol MoS2、0.2 mol Na2CO3、0.4molH2,在1100K时发生反应,达到平衡时恰好处于图中A点,则此温度下该反应的平衡常数为___________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种检测空气中甲醛(HCHO)含量的电化学传感器的工作原理如图所示。下列说法正确的是

A. 传感器工作时,工作电极电势高
B. 工作时,H+通过交换膜向工作电极附近移动
C. 当导线中通过1.2×l0-6 mol电子,进入传感器的甲醛为3×10-3 mg
D. 工作时,对电极区电解质溶液的pH增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物G是合成某种哮喘药的中间体,G的合成路线如图,请回答下列问题:

已知:I.化合物A的核磁共振氢谱有4组吸收峰。
Ⅱ.通常情况下,在同一个碳原子上连有两个羟基不稳定,易脱水形成羰基。
Ⅲ.醛能发生羟醛缩合反应,再脱水生成不饱和醛:

Ⅳ.
(1)A的结构简式是________,名称是________,1mol A完全燃烧消耗氧气的物质的量为________mol。
(2)B生成C的化学方程式是________________________________。
(3)C的分子式为________。
(4)E生成F的反应类型是________________。
(5)G中含氧官能团的名称是________________。
(6)符合下列条件的B的同分异构体共有________种。
①能与氯化铁溶液发生显色反应
②1H—NMR谱显示分子中苯环上有2种不同化学环境的氢原子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】取20 mL pH=3的CH3COOH溶液,加入0.2 mol·L-1的氨水,测得溶液导电性变化如图,则加入氨水前CH3COOH的电离度为( )

A. 0.5% B. 1.0% C. 0.1% D. 1.5%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在呼吸面具和潜水艇中可用过氧化钠作为供氧剂。请选择适当的化学试剂和实验用品,用下图中的实验装置进行实验,证明过氧化钠可作供氧剂。

(1)装置A是CO2气体的发生装置,请写出仪器a的名称__________。
(2)B中盛饱和NaHCO3溶液,其作用是___________。
(3)写出C中过氧化钠与二氧化碳反应的化学方程式____________________。
(4)D中盛放的试剂可以是__________(填序号)。
① 浓H2SO4 ② NaOH溶液 ③ CaCl2溶液 ④ Ca(OH)2溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】雷诺嗪是治疗慢性心绞痛首选新药。雷诺嗪合成路线如下:

(1)雷诺嗪中含氧官能团,除酰胺键(-NHCO-)外,另两种官能团名称:___、____。
(2)写出满足下列条件A的同分异构体的数目_____。①能与FeCl3溶液发生显色反应;②1mol该分子可与2molNaOH反应。
(3)从雷诺嗪合成路线得到启示,可用间二甲苯、ClCH2COCl、(C2H5)NH(无机试剂任用)合成盐酸利多卡因,请在横线上补充反应物,在方框内补充生成物。_____、_____、_____、_____、_____、_____。

盐酸利多卡因
已知:![]()

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【有机化学基础】肉桂醛F (![]() )在自然界存在于桂油中,是一种常用的植物调味油,工业上主要是按如下路线合成的:
)在自然界存在于桂油中,是一种常用的植物调味油,工业上主要是按如下路线合成的:

已知:两个醛分子在NaOH溶液作用下可以发生反应,生成一种羟基醛:
![]() +
+![]()
![]()
![]()
请回答:
(1)D的结构简式为 ;检验其中官能团的试剂为 。
(2)反应①~⑥中属于加成反应的是 (填序号)。
(3)写出有关反应③的化学方程式: 。
(4)在实验室里鉴定(![]() )分子中的氯元素时,是将其中的氯元素转化为AgCl白色沉淀来进行的,其正确的操作步骤是 (请按实验步骤操作的先后次序填写序号)。
)分子中的氯元素时,是将其中的氯元素转化为AgCl白色沉淀来进行的,其正确的操作步骤是 (请按实验步骤操作的先后次序填写序号)。
A.滴加AgNO3溶液 | B.加NaOH溶液 | C.加热 | D.用稀硝酸酸化 |
(5)下列关于E的说法正确的是 (填字母)。
a.能与银氨溶液反应 b.能与金属钠反应
c.1 mol E最多能和3 mol氢气反应 d.可以发生水解
(6)E的同分异构体有多种,其中之一甲符合条件:①苯环上只有一个取代基,②属于酯类,可由H和芳香酸G制得,现测得H分子的红外光谱和核磁共振氢谱如下图:(已知H的相对分子量为32)则甲的结构简式为
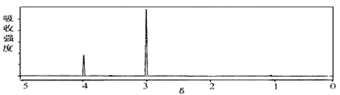
未知物H的核磁共振氢谱

未知物H的红外光谱
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com