
【题目】化合物G是合成某种哮喘药的中间体,G的合成路线如图,请回答下列问题:

已知:I.化合物A的核磁共振氢谱有4组吸收峰。
Ⅱ.通常情况下,在同一个碳原子上连有两个羟基不稳定,易脱水形成羰基。
Ⅲ.醛能发生羟醛缩合反应,再脱水生成不饱和醛:

Ⅳ.
(1)A的结构简式是________,名称是________,1mol A完全燃烧消耗氧气的物质的量为________mol。
(2)B生成C的化学方程式是________________________________。
(3)C的分子式为________。
(4)E生成F的反应类型是________________。
(5)G中含氧官能团的名称是________________。
(6)符合下列条件的B的同分异构体共有________种。
①能与氯化铁溶液发生显色反应
②1H—NMR谱显示分子中苯环上有2种不同化学环境的氢原子
【答案】![]() 对甲基苯酚 8.5
对甲基苯酚 8.5  C7H6O2Cl2 氧化反应 羧基 羟基
C7H6O2Cl2 氧化反应 羧基 羟基
【解析】
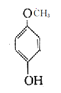
根据化合物A的分子式为C7H8O,核磁共振氢谱有4组吸收峰,所以A的结构简式是![]() ,根据反应条件知B为
,根据反应条件知B为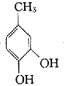 C为
C为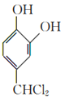 ,D为
,D为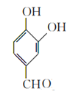 ,E为
,E为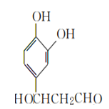
G为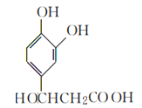 。
。
(1)化合物A的分子式为C7H8O,核磁共振氢谱有4组吸收峰,所以A的结构简式是![]() 。
。
名称是对甲基苯酚,由A的分子式为C7H8O知1mol A完全燃烧生成7molCO2和4molH2O,所以需要消耗氧气的物质的量为8.5mol。答案:![]() ;对甲基苯酚;8.5。
;对甲基苯酚;8.5。
(2)由B的结构![]() 和氯气在光照的条件下发生取代反应,生成C的化学方程式是
和氯气在光照的条件下发生取代反应,生成C的化学方程式是 。答案:
。答案: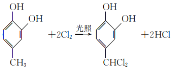 。
。
(3)由C的结构简式 知C的分子式为C7H6O2Cl2。
知C的分子式为C7H6O2Cl2。
(4)根据![]() 的反应条件知醛被新制的氢氧化铜氧化发生了氧化反应,故E生成F的反应类型是氧化反应。
的反应条件知醛被新制的氢氧化铜氧化发生了氧化反应,故E生成F的反应类型是氧化反应。
(5)根据 的反应条件知G的结构简式为
的反应条件知G的结构简式为 ,G中含由羧基和羟基,所以G中氧官能团的名称是羧基和羟基。
,G中含由羧基和羟基,所以G中氧官能团的名称是羧基和羟基。
(6)由B的结构简式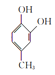 知符合①能与氯化铁溶液发生显色反应;②1H—NMR谱显示分子中苯环上有2种不同化学环境的氢原子的同分异构体共有:
知符合①能与氯化铁溶液发生显色反应;②1H—NMR谱显示分子中苯环上有2种不同化学环境的氢原子的同分异构体共有: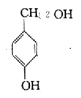
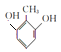
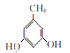 ,共有4种。答案:4种。
,共有4种。答案:4种。


科目:高中化学 来源: 题型:
【题目】缩醛是一类重要的香料,广泛应用于化妆品、食物、饮料等行业。G是一种常用的缩醛,分子中含有一个六元环和一个五元环结构。G可以由如图途径合成:

已知:I.A的分子式为C7H8,属于芳香烃;D的产量可以用来衡量一个国家石油化工发展水平;
Ⅱ.缩醛化反应原理:

Ⅲ.同一个碳原子连接两个羟基不稳定,易脱水形成羰基。
请回答下列问题:
(1)F的名称为______________________。
(2)写出由A生成B的化学方程式:______________________。
(3)反应①的条件为___________;反应②的反应类型为___________。
(4)有研究发现,维生素C可以作为合成G物质的催化剂,具有价廉效率高、污染物少的优点,维生素C的结构简式为 。则维生素C分子中含氧官能团的名称为___________、___________。
。则维生素C分子中含氧官能团的名称为___________、___________。
(5)缩醛G的结构简式为___________。同时满足下列条件的G的同分异构体有___________种(不考虑立体异构);其中核磁共振氢谱为六组峰,且峰面积之比为1:1:2:2:2:2的结构简式为______________________。
①苯环上只有两个取代基
②既能发生银镜反应,又能与FeCl3溶液发生显色反应
(6)D的一种含4个碳原子的无支链同系物H,所有碳原子一定在同一平面上。H作为原料可用于制取目前产量居第二位的顺丁橡胶。试写出该合成路线(其他试剂任选):______________________ ![]() 顺丁橡胶。
顺丁橡胶。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)下列物质中,属于强电解质的是(填序号,下同)__________,属于弱电解质的是________,属于非电解质_____________;
①氨气 ②氨水 ③盐酸 ④醋酸 ⑤硫酸钡 ⑥氯化银 ⑦氯化钠 ⑧二氧化碳 ⑨醋酸铵 ⑩氢气
(2)常温下,取0.2 mol/L HCl溶液与0.2mol/L MOH溶液等体积混合,测得混合后溶液的pH=5。写出MOH的电离方程式:__________________。
(3)甲、乙两瓶氨水的浓度分别为1 molL-1、0.1 molL-1,则c(OH﹣)甲 :c(OH﹣)乙_________10(填“大于”、“等于”或“小于”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】稠环芳烃如萘![]() 、菲
、菲 、芘
、芘 等均为重要的有机化工原料。下列说法正确的是
等均为重要的有机化工原料。下列说法正确的是
A. 萘、菲、芘互为同系物B. 萘、菲、芘的一氯代物分别为2、5、3种
C. 萘、菲、芘中只有萘能溶于水D. 萘、菲、芘的所有原子不可能处于同一平面
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究发现,铝元素能损害人的脑细胞。适当地补充碘元素可预防甲状腺肿大,但摄入过多也会导致甲状腺肿大,因此补充人体所需的元素时也要适可而止。试回答下列问题:
(1)Fe也是人体需要补充的元素之一,试写出Fe2+的核外电子排布式:________。
(2)与Al同一周期的Na、Mg元素也是人体所需元素,Na、Mg、Al基态原子第一电离能的大小关系是________。
(3)氯化铝的熔点是194℃,氧化铝的熔点是2054℃,但是工业上不能用电解熔融氯化铝的方法获取铝单质,这是因为________________________________________。
(4)F与I是同一主族的元素,BeF2与H2O都是由三个原子构成的共价化合物分子,二者分子中的中心原子Be和O的杂化方式分别为________、________,BeF2分子的立体构型是________,H2O分子的立体构型是________。
(5)I2晶体的晶胞结构如图所示,该晶胞中含有________个I2分子,设该晶胞的晶胞参数为acm,则I2的密度是________________g·cm-3。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Se是迄今为止发现的最重要的抗衰老元素,也有抗癌之王的美誉。回答下列问题:
(1)基态Se原子核外电子占据的轨道中,电子云轮廓图形状为哑铃形的有 _____个;第四周期的过渡金属中,基态原子核外未成对电子数与基态Se原子相同的有____种。
(2)Se及其同周期相邻元素相比,三种元素的基态原子的第一电离能由大到小的顺序为____。
(3) H2Se属于____(填“极性”或“非极性”)分子;其熔点低于同条件下NaH熔点的原因为______。
(4) SeO2的立体构型为____。SeO3中Se原子的杂化形式为____。
(5)写出一种与SeO42-互为等电子体的分子式____.
(6)Se能与 形成具有多种生物活性的配合物。1mol
形成具有多种生物活性的配合物。1mol 中含有σ键的数目为 ___。
中含有σ键的数目为 ___。
(7)硒化锌是一种重要的半导体材料,其立方晶胞结构如图所示。若晶胞参数为apm,阿伏加德罗常数的值为NA晶体密度为ρ g·cm-3,则硒化锌的摩尔质量可表示为 ___。(列出计算式即可)

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学习小组查阅资料可知高温下,FeCl2与O2反应一定生成Fe2O3,可能生成FeC13或Cl2。该小组同学利用如下装置对该反应进行探究。回答下列问题:
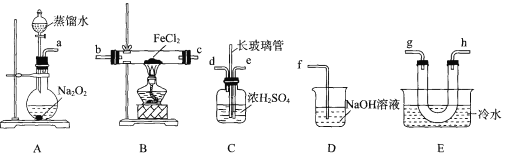
查阅资料:FeCl2固体呈绿色,熔点为674℃,沸点为1023℃;FeC13在100℃左右升华。
(l)装置A中盛放蒸馏水的仪器名称为____。
(2)按气流从左到右的顺序,上述装置合理的连接顺序为____(填仪器接口的小写字母)。
(3)装置C中浓硫酸的作用为 ___,长玻璃管的作用为 ___ 。
(4)实验结束后,用D中所得溶液设计实验证明此反应无Cl2生成 ___。
(5)实验过程中,B处硬质玻璃管中的现象为 ___;装置E中冷水的作用为 ____。
(6)由上述实验可知:高温下,FeCl2与O2反应的化学方程式为_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用废蚀刻液(含FeCl2、CuCl2及FeCl3)制备碱性蚀刻液[Cu(NH3)4Cl2溶液和FeCl36H2O的主要步骤:用H2O2氧化废蚀刻液,制备氨气,制备碱性蚀刻液[CuCl2+4NH3=Cu(NH3)4Cl2]、固液分离,用盐酸溶解沉淀并制备FeCl36H2O。下列有关实验说法正确的是( )
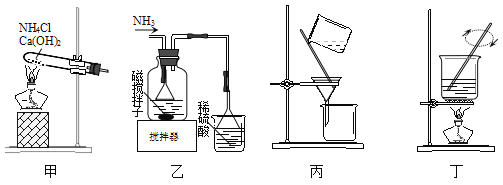
A. 用H2O2氧化废蚀刻液的离子方程式为:2H++2Fe2++H2O2=2Fe3++2H2O
B. 用装置甲可以制备Cu(NH3)4Cl2并沉铁
C. 用装置乙可以分离Cu(NH3)4Cl2溶液和Fe(OH)3
D. 用装置丁由FeCl3溶液制备FeCl36H2O需要经蒸发浓缩、冷却结晶、过滤洗涤等步骤
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com