

| A. | 从海水提取物质不一定都必须通过化学反应才能实现 | |
| B. | 石灰乳是该工业用到的原料之一 | |
| C. | 在过程③⑤中溴元素均被氧化 | |
| D. | 工业上电解饱和MgCl2溶液制备金属镁 |
分析 海水通过蒸发浓缩得到粗盐和母液,粗盐精制除去杂质得到精盐,电解饱和食盐水得到氢氧化钠、氯气和氢气,母液中含有镁离子和溴离子,加入石灰乳沉淀镁离子过滤得到氢氧化镁沉淀和滤液,氢氧化镁溶解后浓缩蒸发,冷却结晶,过滤洗涤,在氯化氢气流中加热失去结晶水得到无水氯化镁,滤液中加入氧化剂氯水氧化溴离子为溴单质,再通入二氧化硫吸收后,加入酸重新生成溴单质,
A.海水经晒盐可得到粗盐,为物理变化;
B.步骤中母液得到氢氧化镁沉淀的反应是利用石灰乳和氯化镁反应生成;
C.在第③、⑤步骤中发生的反应为2NaBr+Cl2=2NaCl+Br2,在第④步骤中发生的反应为Br2+SO2+2H2O=H2SO4+2HBr;
D.氯化镁易水解,为防止氯化镁水解,由MgCl2•6H2O在HCl气体的环境下,加热制取无水MgCl2,活泼金属采用电解熔融盐或熔融氧化物的方法冶炼.
解答 解:A.海水经晒盐可得到粗盐,为物理变化,而从海水中提取溴、碘、镁等物质一定发生化学变化,故A正确;
B.母液得到氢氧化镁沉淀的反应是利用石灰乳和氯化镁反应生成,石灰乳是该工业用到的原料之一,故B正确;
C.在第③、⑤步骤中发生的反应为2NaBr+Cl2=2NaCl+Br2,在第④步骤中发生的反应为Br2+SO2+2H2O=H2SO4+2HBr,所以在第③、⑤步骤中,溴元素均被氧化,在第④步骤的溴做氧化剂,故C正确;
D.工业上电解饱和MgCl2溶液阳极上是氯离子失电子发生氧化反应生成氯气,阴极上是溶液中氢离子得到电子生成氢气,同时生成氢氧化镁沉淀,不能制备金属镁,工业上采用电解熔融氯化镁的方法冶炼镁,故D错误;
故选D.
点评 本题考查了海水资源的综合利用,涉及物质的鉴别、氧化还原反应、金属的冶炼等知识点,明确反应原理是解本题关键,知道每一步发生的反应,根据物质的性质分析解答,注意溴元素的富集过程,题目难度中等.


科目:高中化学 来源: 题型:选择题
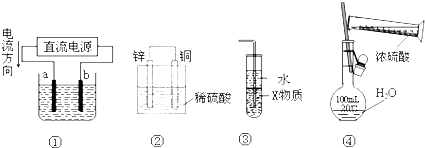
| A. | 若采用装置①精炼铜,则a极为纯铜,b极为粗铜,电解质溶液为CuSO4溶液 | |
| B. | 装置②是原电池,工作时SO42-离子向铜极移动 | |
| C. | 装置③中X若为四氯化碳,则此装置可用于吸收氨气,并防止倒吸 | |
| D. | 装置④可用于实验室配置一定物质的量浓度的稀硫酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 侯氏制碱法的工艺过程中应用了物质溶解度的差异 | |
| B. | 工业上以氯气和石灰乳为原料制备漂白粉 | |
| C. | 单质硅常用做光导纤维的材料,这与硅的半导体性能有一定关系 | |
| D. | 高压钠灯发出的黄光射程远、透雾能力强,常用做路灯 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 由2Cu+O2 $\frac{\underline{\;△\;}}{\;}$2CuO可推出Cu+S$\frac{\underline{\;△\;}}{\;}$CuS | |
| B. | SO2是酸性氧化物,则SO3也是酸性氧化物 | |
| C. | 相同质量的N4和N2所含原子个数比为1:1 | |
| D. | 石墨、金刚石、C60为同素异形体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na>Be>C>F | B. | S2->S>O>F | C. | S2->Cl->K+>Ca2+ | D. | Cl>Li>N>He |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com