
| A. | Na>Be>C>F | B. | S2->S>O>F | C. | S2->Cl->K+>Ca2+ | D. | Cl>Li>N>He |
分析 离子或原子的电子层越多,离子半径、原子半径越大;电子层相同时,离子或原子的核电荷数越大,离子半径、原子半径越小,据此进行判断.
解答 解:A.钠的电子层最多,原子半径最多,Be、C、F的电子层相同,核电荷数Be<C<F,则原子半径Be>C>F,所以原子半径大小为:Na>Be>C>F,故A正确;
B.S2-、S的电子层相同,硫离子的核外电子总数大于S,则其比较S2->S;O、F的电子层相同,核电荷数F>O,则原子半径F<O,其粒子半径大小为:S2->S>O>F,故B正确;
C.S2-、Cl-、K+、Ca2+的电子层相同,核电荷数依次增大,则离子半径大小为:S2->Cl->K+>Ca2+,故C正确;
D.同一正确中,稀有气体的原子半径最大,则原子半径He>Li>N,故D错误;
故选D.
点评 本题考查微粒半径大小比较,题目难度中等,掌握微粒半径比较规律即可解答,有利于基础知识的巩固,试题培养了学生的灵活应用能力.


 激活思维优加课堂系列答案
激活思维优加课堂系列答案 活力试卷系列答案
活力试卷系列答案 课课优能力培优100分系列答案
课课优能力培优100分系列答案科目:高中化学 来源: 题型:选择题
| A. | 蒸馏、萃取、分液、过滤 | B. | 萃取、蒸馏、分液、蒸发 | ||
| C. | 萃取、蒸馏、分液、过滤 | D. | 蒸馏、萃取、分液、蒸发 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 明矾在水中生成的Al(OH)3胶体有吸附性,因此常用明矾对水进行消毒 | |
| B. | 汽车尾气中含有的氮氧化物,是汽油不完全燃烧产生的 | |
| C. | 氨气很容易液化,液氨汽化吸收大量的热,所以液氨常用作制冷剂 | |
| D. | 为了消除碘缺乏病,在食用盐中加入一定量的碘单质 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 从海水提取物质不一定都必须通过化学反应才能实现 | |
| B. | 石灰乳是该工业用到的原料之一 | |
| C. | 在过程③⑤中溴元素均被氧化 | |
| D. | 工业上电解饱和MgCl2溶液制备金属镁 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,22.4LH2O含有的分子数为1 NA | |
| B. | 常温常压下,1.06g Na2CO3含有的Na+离子数为0.02 NA | |
| C. | 通常状况下,1 NA 个CO2分子占有的体积为22.4L | |
| D. | 在0.5mol/L的Mg SO4溶液中,Mg2+数目为0.5 NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 煤经过气化和液化等物理变化可以转化为清洁燃料 | |
| B. | Al2(SO4)3可用于对自来水进行消毒 | |
| C. | 大型制冷设备的液氨大量泄漏不会对操作人员有损害 | |
| D. | 静电除尘与胶体性质相关 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 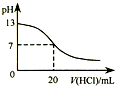 如图表示25℃时,用0.1 mol•L-1盐酸滴定20 mL 0.1 mol•L-1 NaOH溶液,溶液的pH随加入酸体积的变化 | |
| B. | 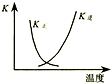 图中曲线表示反应2SO2(g)+O2(g)?2SO3(g);△H<0 正、逆反应的平衡常数K随温度的变化 | |
| C. | 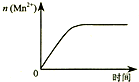 图③表示10 mL 0.01 mol•L-1 KMnO4 酸性溶液与过量的0.1 mol•L-1 H2C2O4溶液混合时,n(Mn2+) 随时间的变化 | |
| D. | 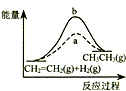 图中a、b曲线分别表示反应CH2=CH2 (g)+H2(g)→CH3CH3(g);△H<0使用和未使用催化剂时,反应过程中的能量变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com