
【题目】SO2、NO2能形成酸雨,某同学以它们为主题设计了两组实验:
(实验一)用三只集气瓶收集满二氧化硫、二氧化氮气体,然后将其倒置在水槽中.分别缓慢通入适量O2或Cl2,如图A、B、C所示。一段时间后,A、B装置的集气瓶中充满溶液(假设瓶内液体不扩散),C装置的集气瓶中还有气体剩余(考虑液体的扩散) 。

(1)写出装置A中总反应的化学方程式_____________________________,假设该实验条件下,气体摩尔体积为a L/mol,则装置A的集气瓶中所得溶液溶质的物质的量浓度为______________。
(2)写出B装置的溶液充满集气瓶时,有关反应的离子方程式_______________。
(3)实验前在C装置的水槽里滴加几滴紫色石蕊试液,通入氧气后,可观察到的实验现象是水槽中溶液___________________________(答颜色的变化),写出反应的总化学方程式____________________________________。
(实验二)利用上图B的原理,设计下图装置测定某硫酸工厂排放尾气中二氧化硫的含量,图中气体流量计用于准确测量通过的尾气体积。将尾气通入一定体积的碘水,并通过实验测定SO2的含量。当洗气瓶D中溶液蓝色刚好消失时,立即关闭活塞K。

(4)D中导管末端连接一个多孔球泡E,其作用是_______________________,可以提高实验的准确度。
(5)当流量计中刚好通过2L尾气时,D中溶液蓝色刚好消失,立即关闭活塞K,容器D中恰好得到100mL溶液,将该溶液全部转移至锥形瓶中,滴入过量BaCl2溶液,过滤、洗涤、干燥,得到4.66g 白色沉淀,通过计算可知,上述尾气中二氧化硫的含量为________g/L。若洗气瓶D中溶液蓝色消失后,没有及时关闭活塞K,测得的SO2含量_________(填“偏高”、“偏低”或“无影响”)。
【答案】 4NO2+O2+2H2O===4HNO3 1/a mol/L SO2+Cl2+2H2O===4H++SO42﹣+2Cl﹣ 红色加深 2SO2+O2+2H2O===2H2SO4 (2H2SO3+O2===2H2SO4 也可) 有利于SO2与碘水反应(或被碘水充分吸收) 0.64 偏低
【解析】【实验一】由题意可知,A瓶NO2、O2按适当比例混合可以完全溶于水生成HNO3;B中二氧化硫和氯气适当比例混合可以完全溶于水生成硫酸和盐酸;C中二氧化硫溶于水生成亚硫酸,通入氧气后可以把部分亚硫酸氧化为硫酸,据此解答。
【实验二】将尾气通入一定体积的碘水,碘水把二氧化硫氧化为硫酸:SO2+I2+2H2O=H2SO4+2HI,根据碘遇淀粉显蓝色判断反应的终点,利用钡离子沉淀硫酸根离子结合方程式计算。
(1)装置A中反应物是氧气、二氧化氮和水,生成物是硝酸,则总反应的化学方程式为4NO2+O2+2H2O=4HNO3;假设该实验条件下,气体摩尔体积为a L/mol,再设集气瓶的容积为1L(集气瓶的容积不影响溶液的浓度),则NO2和HNO3溶液的体积均为1L,则n(HNO3)=n(NO2)=![]() ,因此装置A的集气瓶中所得溶液溶质的物质的量浓度为1/a mol/L。
,因此装置A的集气瓶中所得溶液溶质的物质的量浓度为1/a mol/L。
(2)装置B中氯气与二氧化硫在水中反应生成硫酸和盐酸,因此溶液充满集气瓶时反应的离子方程式为SO2+Cl2+2H2O=4H++SO42﹣+2Cl﹣。
(3)实验前在C装置的水槽里滴加几滴紫色石蕊试液,通入氧气后,可观察到的实验现象是溶液颜色加深,说明溶液的酸性增强,因此反应的总化学方程式为2SO2+O2+2H2O=2H2SO4 (或2H2SO3+O2=2H2SO4)。
(4)D中导管末端连接一个多孔球泡E,其作用是增大二氧化硫与碘水反应的接触面积,有利于SO2与碘水反应(或被碘水充分吸收),可以提高实验的准确度。
(5)当流量计中刚好通过2L尾气时,D中溶液蓝色刚好消失,立即关闭活塞K,容器D中恰好得到100mL溶液是硫酸和氢碘酸的混合溶液,将该溶液全部转移至锥形瓶中,滴入过量BaCl2溶液,过滤、洗涤、干燥,得到4.66g白色沉淀,该沉淀为硫酸钡,其物质的量为4.66g÷233g/mol=0.02mol,则根据硫原子守恒可知n(SO2)=0.02mol,所以上述尾气中二氧化硫的含量为0.02mol×64g·mol-1/2L=0.64 g/L。若洗气瓶D中溶液蓝色消失后,没有及时关闭活塞K,则尾气体积偏大,必然导致测得的SO2含量偏低。


科目:高中化学 来源: 题型:
【题目】镁、铝在生产生活中有广泛的应用.回答下列问题:
(1)铝的原子结构示意图为 . 它位于元素周期表的第周期,第族.
(2)实验室制备氢氧化铝的常用方法是在氯化铝溶液中滴加氨水,反应的离子方程式为 .
(3)常温下,铁跟水不反应,但红热的铁会跟水蒸气发生反应,反应的化学方程式为 .
(4)检验某溶液中是否含有Fe3+的操作方法是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2017年5月9日,最新发现的第113号、115号、117号和118号元素终于有了中文名称

根据元素周期律知识,下列预测或说法肯定不合理的是( )
A. Nh的最高价氧化物对应的水化物的化学式为H3NhO3是一种强酸
B. Mc的最高价阳离子为Mc5+,氧化性比较弱
C. Og是第七周期中的最后一种元素,其原子序数是所有已发现元素中最大的
D. 根据金属和非金属的分界线,Ts的中文名称为“钿”可能更合理
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于氧化还原反应的叙述正确的是
A.含最高价元素的化合物一定有强氧化性
B.有一种元素被氧化,肯定有另一种元素被还原
C.还原剂得电子数与氧化剂失电子数一定相等
D.化学反应中不一定所有元素的化合价都发生变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A.胶体与溶液的本质区别在于是否具有丁达尔效应
B.电解质电离需要通电才能实现
C.只含有一种元素的物质一定是纯净物
D.向Fe(OH)3胶体中逐滴滴加稀硫酸,先出现沉淀,后来沉淀溶解
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素W、X、Y、Z的原子序数依次递增,a、b、C、d.e、f是由这些元素组成的化合物,d为淡黄色的离子化合物,m为元素Y的单质,通常为无色无味的气体。上述物质的转化关系如图所示。下列说法正确的是

A. 原子半径:W<X<Y<Z
B. 简单气态氢化物的热稳定性:X>Y
C. 图中物质的转化过程均为氧化还原反应
D. a一定由W、X两种元素组成
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】
(1)丙烷燃烧可以通过以下两种途径:
途径I:C3H8(g) + 5O2(g) = 3CO2(g) +4H2O(l) ΔH=-a kJ·mol-1
途径II:C3H8(g) = C3H6(g)+ H2(g) ΔH=+b kJ·mol-1
2C3H6(g)+ 9O2(g) = 6CO2(g) +6H2O(l) ΔH=-c kJ·mol-1
2H2(g)+O2 (g) = 2H2O(l) ΔH=-d kJ·mol-1 (abcd均为正值)
请回答下列问题:
①判断等量的丙烷通过两种途径放出的热量,途径I放出的热量(填“大于”、“等于”或“小于”)途径II放出的热量。
②b 与a、c、d的数学关系式是 。
(2)甲醇是一种重要的试剂,有着广泛的用途,工业上可利用CO2制备甲醇。用CH4与CO2反应制H2和CO,再利用H2和CO化合制甲醇。已知:
① 2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(l) △H1=-1450.0kJ·mol-1
② 2CO(g)+O2(g)=2CO2(g) △H2=-566.0kJ·mol-1
③ 2H2(g)+O2(g)=2H2O(l) △H3=-571.6kJ·mol-1
则H2和CO制液态甲醇的热化学方程式为。
(3)如图所示,某同学设计一个甲醚(CH3OCH3)燃料电池并探究氯碱工业原理和粗铜的精炼原理,其中乙装置中X为阳离子交换膜.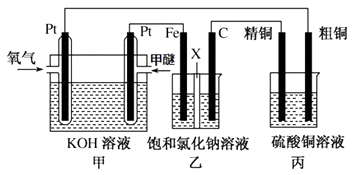
报据要求回答相关问题:
①写出甲中通甲醚一极的电极反应式。
②乙中发生的总反应的离子方程式为。
③将0.2mol AgNO3、0.4mol Cu(NO3)2 、0.6mol KCl溶于水,配成100ml溶液,用惰性电极电解一段时间后,某一电极上析出了0.3mol Cu,此时在另一电极上产生的气体体积(标准状况)为 L,若要使电解质溶液恢复到电解前的状态,需要加入固体的质量为g 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由有机物A和F合成I、J和高聚物H的流程如下:

已知:①
②
③有机物B的分子式为C4H6Br2,其核磁共振氢谱有2组峰,且峰面积之比为1:2。
请回答下列问题
(1)有机物F的名称是________,反应⑤利用试剂a的哪种性质? ________________填“氧化性”或“还原性”)。
(2)高聚物H的结构简式为_____________,已知J中含有一个六元环,则J的结构简式为________________。
(3)D→E的化学方程式为________________,反应类型为________________。
(4)1mol的E生成I最多可以消耗________molH2,B和C的相对分子质量的差值为________。
(5)C的同分异构体中满足下列条件的有________种。
①可以发生银镜反应 ②可以与金属钠反应产生氢气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】环境保护要求燃煤污染物控制排放,研究协同脱硫脱硝工艺是大势所趋。
Ⅰ量子化学计算能揭示出化学反应机理。
SO2与ClO2的气态反应中,因接触位置不同,形成了不同反应路径,反应中各驻点(TS为过渡态,RC、IM、PC为中间产物)相对初始反应物的能量关系如图1所示
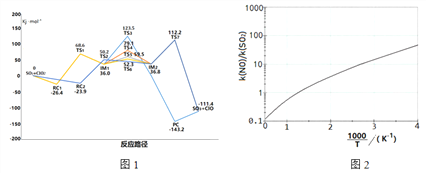
(1)写出该过程的热化学方程式:____________________。
(2)图中IM1→IM2,经历过渡态_____的路径反应速率最慢,其原因是______。
(3)在图中描线指出该反应的最优微观路径。____________
(4)产物ClO也有强氧化性,可以继续氧化SO2。请写出该反应的化学方程式______。
(5)ClO2分别氧化NO和SO2反应速率常数之比与温度关系如图2所示,可推知随温度升高,ClO2氧化NO反应速率_______。
Ⅱ模拟烟气的组成为:0.03%NO、0.1%SO2、6.0%O2、8.0%H2O,在70℃下,当n(C1O2):n(NO)不断增大(其余为氮气)时,SO2和NO的转化率变化如图3所示。
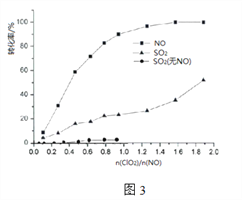
(6)有NO存在时,ClO2氧化SO2______(填“难”、“易”),造成这种情况的可能原因是________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com