
【题目】由有机物A和F合成I、J和高聚物H的流程如下:

已知:①
②
③有机物B的分子式为C4H6Br2,其核磁共振氢谱有2组峰,且峰面积之比为1:2。
请回答下列问题
(1)有机物F的名称是________,反应⑤利用试剂a的哪种性质? ________________填“氧化性”或“还原性”)。
(2)高聚物H的结构简式为_____________,已知J中含有一个六元环,则J的结构简式为________________。
(3)D→E的化学方程式为________________,反应类型为________________。
(4)1mol的E生成I最多可以消耗________molH2,B和C的相对分子质量的差值为________。
(5)C的同分异构体中满足下列条件的有________种。
①可以发生银镜反应 ②可以与金属钠反应产生氢气
【答案】 1,4-二甲苯或对二甲苯 氧化性 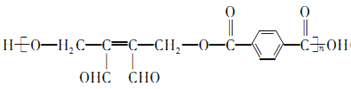
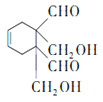
 加成反应 3 126 5
加成反应 3 126 5
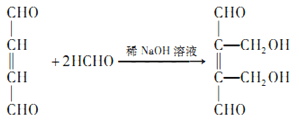
【解析】有机物B的分子式为C4H6Br2,其核磁共振氢谱有2组峰,且峰面积之比为1:2,故分子高度对称,A与溴发生1,4-加成生成B,B为1,4-二溴-2-丁烯BrCH2CH=CHCH2Br;BrCH2CH=CHCH2Br在氢氧化钠的水溶液中发生取代反应生成C为HOCH2CH=CHCH2OH,HOCH2CH=CHCH2OH在铜的催化下发生氧化反应生成D为OHCCH=CHCHO,OHCCH=CHCHO在稀氢氧化钠溶液中与足量甲醛发生类似已知①反应生成E为 ,
, 与A(1,3-丁二烯)发生类似已知②的加成反应生成J为
与A(1,3-丁二烯)发生类似已知②的加成反应生成J为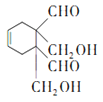 ,
, 与G(对苯二甲酸)发生缩聚反应生成H为
与G(对苯二甲酸)发生缩聚反应生成H为 。(1)有机物F为
。(1)有机物F为![]() ,名称是1,4-二甲苯或对二甲苯,反应⑤是对二甲苯被酸性高锰酸钾溶液氧化生成对苯二甲酸,利用试剂a的氧化性;(2)高聚物H的结构简式为
,名称是1,4-二甲苯或对二甲苯,反应⑤是对二甲苯被酸性高锰酸钾溶液氧化生成对苯二甲酸,利用试剂a的氧化性;(2)高聚物H的结构简式为 ,已知J中含有一个六元环,则J的结构简式为
,已知J中含有一个六元环,则J的结构简式为 ;(3)D→E是OHCCH=CHCHO在稀氢氧化钠溶液中与足量甲醛发生反应生成
;(3)D→E是OHCCH=CHCHO在稀氢氧化钠溶液中与足量甲醛发生反应生成 ,反应的化学方程式为
,反应的化学方程式为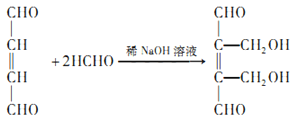 ,反应类型为加成反应;(4)
,反应类型为加成反应;(4) 中含有一个碳碳双键和二个醛基,故1mol的E生成I最多可以消耗3molH2,B(BrCH2CH=CHCH2Br)和C(HOCH2CH=CHCH2OH)的相对分子质量的差值为80×2-17×2=126;(5)C为HOCH2CH=CHCH2OH,同分异构体中满足条件:①可以发生银镜反应则含有醛基,②可以与金属钠反应产生氢气,则另一个氧应是羟基,分子中不含有碳碳双键,符合条件的有CH3CH2CH(OH)CHO、(CH3)2C(OH)CHO、OHCCH2CH(OH)CH3、HOCH2CH(CH3)CHO、HOCH2CH2CHO共5种同分异构体。
中含有一个碳碳双键和二个醛基,故1mol的E生成I最多可以消耗3molH2,B(BrCH2CH=CHCH2Br)和C(HOCH2CH=CHCH2OH)的相对分子质量的差值为80×2-17×2=126;(5)C为HOCH2CH=CHCH2OH,同分异构体中满足条件:①可以发生银镜反应则含有醛基,②可以与金属钠反应产生氢气,则另一个氧应是羟基,分子中不含有碳碳双键,符合条件的有CH3CH2CH(OH)CHO、(CH3)2C(OH)CHO、OHCCH2CH(OH)CH3、HOCH2CH(CH3)CHO、HOCH2CH2CHO共5种同分异构体。


科目:高中化学 来源: 题型:
【题目】氢能是一种理想的“绿色能源”,以下有关氢能开发的方式中最理想的是( )
A.大量建设水电站,用电力分解制取氢气
B.利用化石燃料燃烧放热,高温分解水产生氢气
C.在催化剂作用下,利用太阳能分解水
D.利用铁等金属与酸反应产生氢气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】SO2、NO2能形成酸雨,某同学以它们为主题设计了两组实验:
(实验一)用三只集气瓶收集满二氧化硫、二氧化氮气体,然后将其倒置在水槽中.分别缓慢通入适量O2或Cl2,如图A、B、C所示。一段时间后,A、B装置的集气瓶中充满溶液(假设瓶内液体不扩散),C装置的集气瓶中还有气体剩余(考虑液体的扩散) 。

(1)写出装置A中总反应的化学方程式_____________________________,假设该实验条件下,气体摩尔体积为a L/mol,则装置A的集气瓶中所得溶液溶质的物质的量浓度为______________。
(2)写出B装置的溶液充满集气瓶时,有关反应的离子方程式_______________。
(3)实验前在C装置的水槽里滴加几滴紫色石蕊试液,通入氧气后,可观察到的实验现象是水槽中溶液___________________________(答颜色的变化),写出反应的总化学方程式____________________________________。
(实验二)利用上图B的原理,设计下图装置测定某硫酸工厂排放尾气中二氧化硫的含量,图中气体流量计用于准确测量通过的尾气体积。将尾气通入一定体积的碘水,并通过实验测定SO2的含量。当洗气瓶D中溶液蓝色刚好消失时,立即关闭活塞K。

(4)D中导管末端连接一个多孔球泡E,其作用是_______________________,可以提高实验的准确度。
(5)当流量计中刚好通过2L尾气时,D中溶液蓝色刚好消失,立即关闭活塞K,容器D中恰好得到100mL溶液,将该溶液全部转移至锥形瓶中,滴入过量BaCl2溶液,过滤、洗涤、干燥,得到4.66g 白色沉淀,通过计算可知,上述尾气中二氧化硫的含量为________g/L。若洗气瓶D中溶液蓝色消失后,没有及时关闭活塞K,测得的SO2含量_________(填“偏高”、“偏低”或“无影响”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ、水的电离平衡曲线如图所示。
(1)若以A点表示25℃时水的电离平衡的离子浓度,当温度升高到100℃时,水的电离平衡状态移动到B点,则此时水的离子积从变化到。
(2)将pH=8的Ba(OH)2溶液与pH=5的稀盐酸混合,并保持100℃的恒温,致使混合溶液的pH=7,则Ba(OH)2和盐酸的体积比为。
Ⅱ、有A、B、C、D四种强电解质,它们在水中电离时可产生下列离子(每种物质只含一种阴离子且互不重复):阳离子 Na+、Ba2+、NH4+ 阴离子 CH3COO-、Cl-、OH-、SO42-。已知:①A、C溶液的pH均大于7,A、B的溶液中水的电离程度相同;②C溶液和D溶液相遇时只生成白色沉淀,B溶液和C溶液相遇时只生成刺激性气味的气体,A溶液和D溶液混合时无明显现象。
①A是 , B是 。
②用离子方程式表示A溶液呈碱性的原因。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对利用甲烷消除NO2污染进行研究,CH4+2NO2![]() N2+CO2+2H2O。在1L密闭容器中,控制不同温度,分别加入0.50molCH4和1.2molNO2,测得n(CH4)随时间变化的有关实验数据见下表。
N2+CO2+2H2O。在1L密闭容器中,控制不同温度,分别加入0.50molCH4和1.2molNO2,测得n(CH4)随时间变化的有关实验数据见下表。
组别 | 温度 | 时间/min n/mol | 0 | 10 | 20 | 40 | 50 |
① | T1 | n(CH4) | 0.50 | 0.35 | 0.25 | 0.10 | 0.10 |
② | T2 | n(CH4) | 0.50 | 0.30 | 0.18 | 0.15 |
下列说法正确的是( )
A. 由实验数据可知实验控制的温度T2>T1
B. 组别①中,0~20min内,NO2的降解速率为0.0125mol·L-1·min-1
C. 40min时,表格中T2对应的数据为0.18
D. 0~10min内,CH4的降解速率①>②
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于原电池的说法错误的是( )
A.原电池是将化学能转化为电能的装置
B.原电池负极发生氧化反应
C.原电池中,阳离子向负极移动
D.原电池电子流出的一极为负极
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组物质中,按熔点由低到高的顺序排列正确的是( )
①O2、I2、Hg ②PH3、AsH3、NH3 ③Na、K、Rb④Na、Mg、Al
A. ①③ B. ①④
C. ②③ D. ②④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在容积可变的密闭容器中,可逆反应2HI(g) ![]() H2(g)+I2(g)已达平衡,若将体积缩小,在缩小的过程中:
H2(g)+I2(g)已达平衡,若将体积缩小,在缩小的过程中:
(1)正反应速率;(填“变大”“变小”或“不变”)
(2)平衡;(填“移动”或“不移动”)
(3)混合气体的平均相对分子质量;(填“变大”“变小”或“不变”)
(4)混合气体的密度;(填“变大”“变小”或“不变”)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com