
【题目】下列各组物质中,按熔点由低到高的顺序排列正确的是( )
①O2、I2、Hg ②PH3、AsH3、NH3 ③Na、K、Rb④Na、Mg、Al
A. ①③ B. ①④
C. ②③ D. ②④
科目:高中化学 来源: 题型:
【题目】下列关于氧化还原反应的叙述正确的是
A.含最高价元素的化合物一定有强氧化性
B.有一种元素被氧化,肯定有另一种元素被还原
C.还原剂得电子数与氧化剂失电子数一定相等
D.化学反应中不一定所有元素的化合价都发生变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由有机物A和F合成I、J和高聚物H的流程如下:

已知:①
②
③有机物B的分子式为C4H6Br2,其核磁共振氢谱有2组峰,且峰面积之比为1:2。
请回答下列问题
(1)有机物F的名称是________,反应⑤利用试剂a的哪种性质? ________________填“氧化性”或“还原性”)。
(2)高聚物H的结构简式为_____________,已知J中含有一个六元环,则J的结构简式为________________。
(3)D→E的化学方程式为________________,反应类型为________________。
(4)1mol的E生成I最多可以消耗________molH2,B和C的相对分子质量的差值为________。
(5)C的同分异构体中满足下列条件的有________种。
①可以发生银镜反应 ②可以与金属钠反应产生氢气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机化合物K是一种聚酯材料,合成路线如下:

己知:①AlCl3为生成A的有机反应的催化剂
②F不能与银氨溶液发生反应,但能与Na反应。
(1)生成A的有机反应类型为________。生成A的有机反应分为以下三步:
第一步:CH3COCl+AlCl3→CH3CO++AlCl4,
第二步:____________________
第三步:AlCl4-+H+→AlCl3+HCl
请写出第二步反应。
(2)B的化学名称为反应条件①为______________,反应条件②为_______________。
(3)由乙炔生成F的化学方程式为____________________。
(4)F的同分异构体很多,其中能同时满足这以下4个条件的链状化合物共有_________种(包括顺反异构和对映异构);
①含有三种官能团;②能与新制的Cu(OH)2悬浊液反应;③氧原子不与碳碳双键相连
④与Na反应可放出氢气
(5)K的结构简式为_________________。
(6)请以乙炔和丙酮为原料,按照加成、加成、消去的反应类型顺序三步合成天然橡胶的单体。(无机试剂任选)________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知Ka(CH3COOH)=1.7×10-5,Kb(NH3·H2O)=1.7×10-5。25℃时,向40ml浓度均为0.01mol·L-1的盐酸和醋酸(1:1)混合溶液中逐滴加入0.10mol·L-1的氨水,测定过程中电导率和pH变化曲线如图所示,下列说法正确的是

A. a点溶液中,c(CH3COO-)数量级约为10-5
B. b点溶液中,c(NH4+) < c(CH3COOH)
C. c点溶液中,c(NH4+) > c(Cl-)+c(CH3COO-)
D. d点水的电离程度大于c点
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】环境保护要求燃煤污染物控制排放,研究协同脱硫脱硝工艺是大势所趋。
Ⅰ量子化学计算能揭示出化学反应机理。
SO2与ClO2的气态反应中,因接触位置不同,形成了不同反应路径,反应中各驻点(TS为过渡态,RC、IM、PC为中间产物)相对初始反应物的能量关系如图1所示
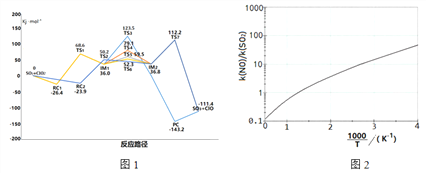
(1)写出该过程的热化学方程式:____________________。
(2)图中IM1→IM2,经历过渡态_____的路径反应速率最慢,其原因是______。
(3)在图中描线指出该反应的最优微观路径。____________
(4)产物ClO也有强氧化性,可以继续氧化SO2。请写出该反应的化学方程式______。
(5)ClO2分别氧化NO和SO2反应速率常数之比与温度关系如图2所示,可推知随温度升高,ClO2氧化NO反应速率_______。
Ⅱ模拟烟气的组成为:0.03%NO、0.1%SO2、6.0%O2、8.0%H2O,在70℃下,当n(C1O2):n(NO)不断增大(其余为氮气)时,SO2和NO的转化率变化如图3所示。
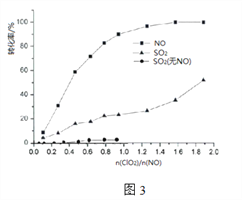
(6)有NO存在时,ClO2氧化SO2______(填“难”、“易”),造成这种情况的可能原因是________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用铁片与稀硫酸反应制取氢气时,下列措施不能使反应速率加快的是( )
A.加热
B.不用稀硫酸改用98%的浓硫酸
C.滴加少量硫酸铜溶液
D.不用铁片,改用铁粉
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】英国曼彻斯特大学科学家安德烈·海姆和康斯坦丁。诺沃肖洛夫。共同工作多年的二人因“突破性地”用撕裂的方法成功获得超薄材料石墨烯而获诺贝尔奖。制备石墨烯方法有石墨剥离法、化学气相沉积法等。石墨烯的球棍模型示意图如下:

(1)下列有关石墨烯说法正确的是_________。
A.键长:石量烯>金刚石
B.石墨烯分子中所有原子可以处于同一平面
C.12g石墨烯含σ键数为NA
D.从石墨剥离得石墨烯需克服石墨层与层之间的分子间作用力
(2)化学气相沉积法是获得大量石墨烯的有效方法之一,催化剂为金、铜、钴等金属或合金,含碳源可以是甲烷、乙炔、苯、乙醇或酞菁等中的一种或任意组合。
①铜原子在基态时,在有电子填充的能级中,能量最高的能级符号为___________;第四周期元素中,最外层电子数与铜相同的元素还有_______________。
②乙醇的沸点要高于相对分子质量比它还高的丁烷,请解释原因_____________。
③下列分子属于非极性分子的是__________。
a.甲烷 b.二氯甲烷 c.苯 d.乙醇
④酞菁与酞菁铜染料分子结构如图,酞菁分子中氮原子采用的杂化方式是__________;酞菁铜分子中心原子的配位数为____________。
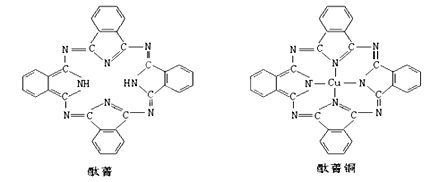
⑤金与铜可形成的金属互化物合金(如图,该晶胞中,Au占据立方体的8个顶点),它的化学式可表示为____________;在Au周围最近并距离相等的Cu有___________个,若2个Cu原子核的最小距离为dpm,该晶体的密度可以表示为_________g/cm3。(阿伏伽德罗常数用NA表示)

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com