

沉淀物 | Fe(OH)3 | Al(OH)3 | Mg(OH)2 |
pH | 3.2 | 5.2 | 12.4 |
部分阳离子以氢氧化物形式完全沉淀时溶液的pH见上表,请回答下列问题:
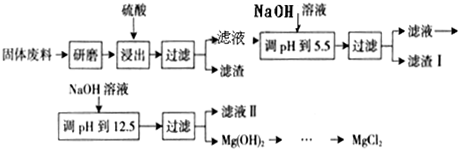
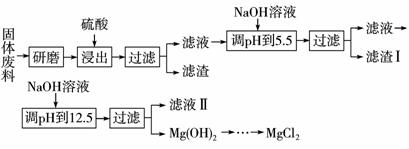
(1)“浸出”步骤中,为提高镁的浸出率,可采取的措施有________________________(要求写出两条)。
(2)滤渣Ⅰ的主要成分有____________________________。
(3)从滤液Ⅱ中可回收利用的主要物质有________________________。
(4)Mg(ClO3)2在农业上可用作脱叶剂、催熟剂,可采用复分解反应制备:
MgCl2+2NaClO3====Mg(ClO3)2+2NaCl
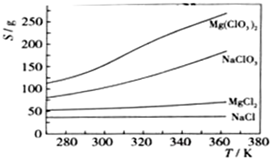
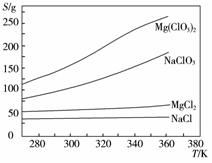
已知四种化合物的溶解度(S)随温度(T)变化曲线如下图所示:
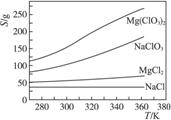
①将反应物按化学反应方程式计量数比混合制备Mg(ClO3)2。简述可制备Mg(ClO3)2的原因:________________________________________________________________________。
②按①中条件进行制备实验。在冷却降温析出Mg(ClO3)2过程中,常伴有NaCl析出,原因是:______________________________。除去产品中该杂质的方法是:_______________________________________________________________________________。
(1)适当提高反应温度、增加浸出时间(或其他合理答案)
(2)Al(OH)3、Fe(OH)3
(3)Na2SO4
(4)①在某一温度时,NaCl最先达到饱和析出;Mg(ClO3)2的溶解度随温度的变化最大;NaCl溶解度与其他物质的溶解度有一定差别
②降温前,溶液中NaCl已饱和;降温过程中,NaCl溶解度降低,会少量析出 重结晶
解析:根据固体废料的变化过程,结合Fe(OH)3、Al(OH)3、Mg(OH)2完全沉淀时的pH可知,pH调节至5.5时,Fe(OH)3、Al(OH)3沉淀完全,pH调到12.5时,Mg(OH)2沉淀完全。滤液Ⅱ中有来自NaOH的Na+和来自H2SO4的![]() ,所以滤液Ⅱ可回收利用的主要物质有Na2SO4。
,所以滤液Ⅱ可回收利用的主要物质有Na2SO4。
复分解反应的发生依赖各物质在水中溶解度的大小差别,若易溶于水的盐中含有NaCl,常采用重结晶法进行分离或除杂。


科目:高中化学 来源: 题型:阅读理解
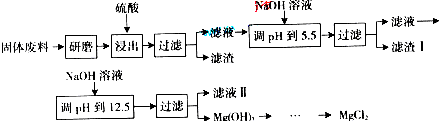
| 沉淀物 | Fe(OH)3 | Al(OH)3 | Mg(OH)2 |
| PH | 3.2 | 5.2 | 12.4 |

查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
| ||
| ||
| △ |
| 沉淀物 | Fe(OH)3 | Al(OH)3 | Mg(OH)2 |
| PH | 3.2 | 5.2 | 12.4 |
查看答案和解析>>
科目:高中化学 来源: 题型:
某厂生产硼砂过程中产生的固体废料,主要含有MgCO3、MgSiO3、CaMg(CO3)2、Al2O3和Fe2O3等,回收其中镁的工艺流程如下:
| 沉淀物 | Fe(OH)3 | Al(OH)3 | Mg(OH)2 |
| pH | 3.2 | 5.2 | 12.4 |
部分阳离子以氢氧化物形式完全沉淀时溶液的pH见上表,请回答下列问题:
(1)“浸出”步骤中,为提高镁的浸出率,可采取的措施有_______________(要求写出两条)
(2)滤渣Ⅰ的主要成分有____________。
(3)从滤液Ⅱ中可回收利用的主要物质有____________。
(4)Mg(ClO3)2在农业上可用作脱叶剂、催熟剂,可采用复分解反应制备:
MgCl2+2NaClO3=Mg(ClO3)2+2NaCl
已知四种化合物的溶解度(S)随温度(T)变化曲线如下图所示:①将反应物按化学反应方程式计量数比混合制备Mg(ClO3)2。简述可制备Mg(ClO3)2的原因:_________________。
②按①中条件进行制备实验。在冷却降温析出Mg
(ClO3)2过程中,常伴有NaCl析出,原因是:
_______________。除去产品中该杂质的方法是:____________。
查看答案和解析>>
科目:高中化学 来源:广东省高考真题 题型:填空题



查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com