
����Ŀ����ϩ��ʯ�ͻ�ѧ��ҵ����Ҫ�Ļ���ԭ�ϣ�����ϩ�����Ƶ����ҵ���Ϻ�����Ʒ����ϩ�ܷ�������ת����ϵ�� 
��1����Ӧ�ٵĻ�ѧ����ʽΪ���÷�Ӧ������Ӧ��
��2��B�����������ŵĵ���ʽΪ �� D�й����ŵ�����Ϊ ��
��3����֪����ϩ������ˮ���е�Ϊ��13.9�棬��Ӧ�ڲ���A����ķ���Ϊ��������ϩ��PVC�����������ϲ�������ͨ�����ϣ�Ӧ�÷dz��㷺�����ھ�����ϩ��˵����ȷ���� �� A�����ڴ����� B������ȼ�� C����ʹ��ˮ��ɫ D��������ʳƷ����Ĥ��
���𰸡�
��1��CH2=CH2+Cl2��CH2Cl��CH2Cl���ӳ�
��2��![]() ���Ȼ�
���Ȼ�
��3������B
���������⣺��ϩ��ˮ�����ӳɷ�Ӧ����BΪCH3CH2OH���Ҵ���D����������Ӧ����������������DΪCH3COOH����ϩ�����������ӳɷ�Ӧ����1��2���������飬1��2���������鷢�����ѽ�õ�A������ϩ����AΪHCl������ϩ�����Ӿ۷�Ӧ���ɾ�����ϩ����1����Ӧ������ϩ�����������ӳɷ�Ӧ����1��2���������飬��Ӧ����ʽΪ��CH2=CH2+Cl2��CH2Cl��CH2Cl�����Դ��ǣ�CH2=CH2+Cl2��CH2Cl��CH2Cl���ӳɣ���2��BΪ�Ҵ���������Ϊ�ǻ�������ʽΪ ![]() ��DΪ���ᣬ���еĹ�����Ϊ�Ȼ������Դ��ǣ�
��DΪ���ᣬ���еĹ�����Ϊ�Ȼ������Դ��ǣ� ![]() ���Ȼ�����3������ϩ������ˮ���е�Ϊ��13.9�棬��Ӧ���ڼ��ȵ������������Ȼ��������ϩ���壬������ϩ�ķе�ϸߣ���������ķ������룬������ϩΪ�߾�����ڻ�������̼̼˫����������ˮ����Ӧ����ȼ�գ�����ϩ�������ڱ���Ĥ�����е����Ӽ��Լ������ͷų������ʶ������к������Դ��ǣ�����B��
���Ȼ�����3������ϩ������ˮ���е�Ϊ��13.9�棬��Ӧ���ڼ��ȵ������������Ȼ��������ϩ���壬������ϩ�ķе�ϸߣ���������ķ������룬������ϩΪ�߾�����ڻ�������̼̼˫����������ˮ����Ӧ����ȼ�գ�����ϩ�������ڱ���Ĥ�����е����Ӽ��Լ������ͷų������ʶ������к������Դ��ǣ�����B��


 ��˼ά������ҵϵ�д�
��˼ά������ҵϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵����ȷ����
A. ![]() ��һ������
��һ������![]() ��һ����ﶼ��4�֣������������칹��
��һ����ﶼ��4�֣������������칹��
B. CH3CH=CHCH3�����е��ĸ�̼ԭ����ͬһֱ����
C. ��ϵͳ�������������� ��������2,3,4-����-2-�һ�����
��������2,3,4-����-2-�һ�����
D. ![]() ��
��![]() ������-�������һ�Ϊͬϵ��
������-�������һ�Ϊͬϵ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����50 mL 0.3 mol/L Fe2(SO4)3��Һ��ˮϡ�͵�500 mL��ϡ�ͺ���Һ��SO42�����ʵ���Ũ��Ϊ
A.0.01 mol/LB.0.03 mol/LC.0.06mol/LD.0.09 mol/L
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ��Ԫ�����ڱ���һ���֣����еĢ�~����Ԫ�أ���Ԫ�ط��Ż�ѧʽ��ջش�
���� | ��A | ��A | ��A | ��A | ��A | ��A | ��A | 0 |
�� | �� | �� | ||||||
�� | �� | �� | �� | �� | �� | �� | ||
�� | �� |
��1������ЩԪ���У���ѧ��������õ�ԭ�ӵ�ԭ�ӽṹʾ��ͼΪ___________��
��2���ؿ��к������Ľ���Ԫ����____________________________��
��3��������γɵĻ�����ĵ���ʽ______________________________��
��4����ЩԪ���е�����������Ӧ��ˮ�����У�������ǿ����___________��������ǿ����____________�������Ե�����������__________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��H��C��N��O��Na��Fe��Cu�dz���������Ԫ�ء�
��1��N��Na+��Fe3+��Cu2+��������̬�ĺ�������Ų�ʽ��δ�ɶԵ�����������____________��
��2�����ݼ۲���ӶԻ��������ж����з��ӻ������пռ乹����V�ε���______����д��ţ���
a. ![]() b.
b. ![]()
c. ![]() d.
d. ![]()
��3������(CN)2�м����֮��ļн�Ϊ180�������жԳ��ԣ�������ÿ��ԭ������������8�����ȶ��ṹ����ṹʽΪ___________��1�������к���_________��������
��4��O��Na�γɵ�һ��ֻ�������Ӽ������ӻ�����侧���ṹ��ͼ�������ӻ�����Ļ�ѧʽΪ_____________����֪�þ������ܶ�Ϊ��g/cm3�������ӵ�����ΪNA�����߳�![]() _______cm�����ú�����NA�Ĵ���ʽ��ʾ��
_______cm�����ú�����NA�Ĵ���ʽ��ʾ��
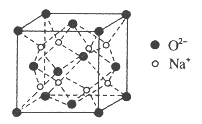
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ס�����Ԫ�����ڱ���ͬһ���������Ԫ�أ�����ԭ������Ϊx�����ҵ�ԭ�������������� ( )
A.x��2B.x��4C.x��8D.x��18
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��̼��һ�ֳ�����Ԫ�أ����Զ�����ʽ�㷺��������Ȼ��֮�С�
��1���Ǽʿռ���ڶ����л����Ӻ������ӣ�����������̼Ԫ�أ�C2��һ���Ǽʷ��ӣ�C2��C60��Ϊ_______________��
��2��CO2��̼Ԫ����Ҫ��������ش������й����⣺
������CO2��Na2O2��Ӧ���������������ṩ�������䷴Ӧ����ʽΪ_________________��
�ڹ�ҵ�Ͽ���CO2��NH3��һ�������ºϳ����أ���Ӧ����ʽΪ2NH3+CO2![]() CO(NH2)2+H2O��
CO(NH2)2+H2O��![]() ʱ��CO2��ת������ʱ��ı仯��ϵ��ͼ��ʾ��
ʱ��CO2��ת������ʱ��ı仯��ϵ��ͼ��ʾ��
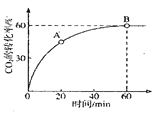
A����淴Ӧ����![]() __________B�������Ӧ����
__________B�������Ӧ����![]() (����ڡ�С�ڡ����ڡ�)��NH3��ƽ��ת����Ϊ____________��
(����ڡ�С�ڡ����ڡ�)��NH3��ƽ��ת����Ϊ____________��
�����ŶԻ���������ʶ�����룬CO2��ת�����������ѳ�Ϊ�����ȵ�֮һ���Ը����������Ķ��Ե缫���������ɵ��CO2ת��ΪCO��װ��ʾ��ͼ���£�
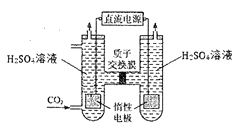
д��ͨCO2��缫��Ӧʽ_________________��
��CO2����������̼�����ϡ���������(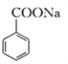 ��дΪC6H5COONa)Ҳ��ijЩ���ϵ����Ӽ��������־����������á��о�����������(C6H5COOH)���־������������ڱ������ơ���������ij���ϵĹ����У��������ӱ��������⣬�����ѹ����CO2���塣������̼��Ķ������룬��д��̼���뱽�����Ʒ�Ӧ�����ӷ���ʽ__________________��������÷�Ӧ�Ļ�ѧƽ�ⳣ��Ϊ______________����ѹ����CO2�����ϵ��־�����������ǿ������������ӷ���ʽ������ԭ��_______________����֪��H2CO3��Ka1��4.17��10��7��C6H5COOH��Ka��6.25��10��5������
��дΪC6H5COONa)Ҳ��ijЩ���ϵ����Ӽ��������־����������á��о�����������(C6H5COOH)���־������������ڱ������ơ���������ij���ϵĹ����У��������ӱ��������⣬�����ѹ����CO2���塣������̼��Ķ������룬��д��̼���뱽�����Ʒ�Ӧ�����ӷ���ʽ__________________��������÷�Ӧ�Ļ�ѧƽ�ⳣ��Ϊ______________����ѹ����CO2�����ϵ��־�����������ǿ������������ӷ���ʽ������ԭ��_______________����֪��H2CO3��Ka1��4.17��10��7��C6H5COOH��Ka��6.25��10��5������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������м����һ��������ϡ���ᷴӦ���ڶ�������������������Һ��Ӧ�������������������Ϊ1��2�����һ����ڶ�����м��������Ϊ�� ��
A.1��1
B.2��1
C.1��3
D.1��2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ�Dz��ֶ�����Ԫ�صij������ϼ���ԭ�������Ĺ�ϵͼ��
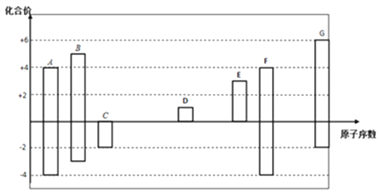
��1��Ԫ��A�����ڱ��е�λ��_________��
��2���õ���ʽ��ʾD2G���γɹ���_________________��
��3��C��D��G��Ӧ�ļ����Ӱ뾶��С˳����__________(�����ӷ��Żش�)��
��4��ijͬѧ���ʵ��װ����ͼ��ʾ��֤��A��B��F�ķǽ�����ǿ����ϵ��
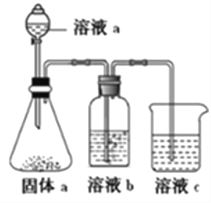
����Һa����Һb�ֱ�Ϊ__________��__________��
����Һc�е����ӷ�Ӧ����ʽΪ___________��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com