
| 编号 | 0.01mol/L NaHSO3溶液/mL | 0.01mol/L KIO3 溶液/mL | H2O/mL | 反应温度/ ℃ | 溶液变蓝所用 时间t/s |
| ① | 6.0 | 10.0 | 4.0 | 15 | t1 |
| ② | 6.0 | 14.0 | 0 | 15 | t2 |
| ③ | 6.0 | a | b | 25 | t3 |
| 实验步職(不要求写出具体搡作过程) | 预期实验现象和结论 |
| 在烧杯甲中将一定量的NaHSO3溶液与KIO3溶液混合,用速率检测仪测定起始时的反应速率v(甲); 在烧杯乙中预先加入少量Na2SO4粉末,其他条件与甲完全相同,进行同一反应, 用速率检测仪测定其起始阶段相同时间内的反应速率v(乙). | 若v(甲)=v(乙) 则假设一不成立 若v(甲)<v(乙),则假设一成立 |
分析 (1)NaHSO3溶液中加入稍过量的KIO3溶液,一段时间后,溶液突然变蓝色,说明产物中有碘单质生成,由于有第一步反应IO3-+3HSO3-=3SO42-+3H+-+I-,且KIO3溶液过量,所以能产生碘单质的反应为IO3-+5I-+6H+=3I2+3H2O,据此答题;
(2)根据表格,对比①②的数据,可以看出KIO3的浓度不一样,其它条件都一样,据此判断实验目的;浓度越大,反应速率越快,需要的时间则越小;实验①③是探究温度对反应速率的影响,所以此时两个实验中的浓度都应当相等,据此答题;
(3)根据影响反应速率的外界因素有浓度、温度、催化剂等,以此加以假设;
(4)通过对比实验进行验证,生成的SO42-对反应起催化作用,则在其中一个实验中先进入硫酸钠,根据反应速率进行判断.
解答 解:(1)NaHSO3溶液中加入稍过量的KIO3溶液,一段时间后,溶液突然变蓝色,说明产物中有碘单质生成,由于有第一步反应IO3-+3HSO3-=3SO42-+3H+-+I-,且KIO3溶液过量,所以能产生碘单质的反应为IO3-+5I-+6H+=3I2+3H2O,
故答案为:IO3-+5I-+6H+=3I2+3H2O;
(2)根据表格,对比①②的数据,可以看出KIO3的浓度不一样,所以实验①②是探究浓度对反应速率的影响;由于浓度越大,反应速率越快,则t2较小;
实验①③是探究温度对反应速率的影响,所以此时两个实验中的浓度都应当相等,所以a=10.0、b=4.0,
故答案为:KIO3溶液的浓度;>;10.0;4.0;
(3)根据影响反应速率的外界因素有浓度、温度、催化剂等加以假设,而在本实验中可能的原因为反应生成的I-对反应起催化作用,I-浓度越大反应速率越快或者反应生成的H+对反应起催化作用,H+浓度越大反应速率越快或者是反应放热,随着反应的进行,温度升高,反应速率加快,
故答案为:反应生成的I-对反应起催化作用(或反应生成的H+对反应起催化作用);
(4)通过对比实验进行验证,具体步骤为在烧杯甲中将一定量的NaHSO3溶液与KIO3溶液混合,用速率检测仪测定其起始时的反应速率v(甲);在烧杯乙中预先加入少量Na2SO4粉末,其他条件与甲完全相同,进行同一反应,用速率检测仪测定其起始阶段相同时间内的反应速率v(乙),若v(甲)=v(乙),则假设一不成立,若v(甲)<v(乙),则假设一成立,
故答案为:在烧杯乙中预先加入少量Na2SO4粉末,其他条件与甲完全相同,进行同一反应,用速率检测仪测定其起始阶段相同时间内的反应速率v(乙);若v(甲)=v(乙),则假设一不成立;若v(甲)<v(乙),则假设一成立.
点评 本题考查了探究影响化学反应速率的因素的方法,题目难度中等,明确实验目的及对比实验的设计方法为解答关键,试题侧重考查学生的分析、理解能力及灵活应用基础知识的能力,注意熟练掌握温度、催化剂、浓度等因素对化学反应速率的影响.


科目:高中化学 来源: 题型:选择题
| A. | 乳酸是一种氧化物 | |
| B. | 1个乳酸分子是由3个碳原子和3个水分子构成 | |
| C. | 葡萄糖与乳酸中所含的原子种类相同 | |
| D. | 葡萄糖不能为人体提供能量 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
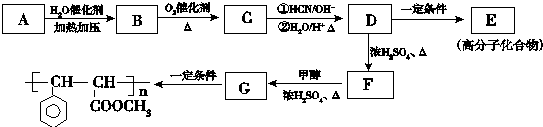
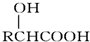
 .
. .
.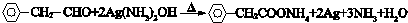 .
. .
.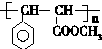 与足量氢氧化钠溶液反应的化学方程式
与足量氢氧化钠溶液反应的化学方程式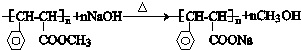 .
.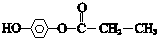 .
.查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| R | T | |
| X | Y | Z |
| A. | R位于元素周期表中第二周期第VIA族 | |
| B. | 五种元素中原子序数最大的是X | |
| C. | 气态氢化物稳定性:T>Y | |
| D. | Z元素的最高价氧化物对应的水化物的化学式为H2ZO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1mol | B. | 1.5mol | C. | 2mol | D. | 2.5mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
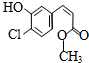
| A. | 该有机物的摩尔质量为200 | |
| B. | 该有机物属于芳香烃 | |
| C. | 该有机物可发生取代、加成、加聚、氧化、还原、消去反应 | |
| D. | 1 mol该有机物在适当条件下,最多可与4mol NaOH和4mol H2反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 苯、乙醇、四氯化碳都是重要有机溶剂,都可用于提取碘水中的碘单质 | |
| B. | 可用蘸浓硫酸的玻璃棒检验输送氨气的管道是否漏气 | |
| C. | 往装有铁钉的试管中加入2 mL水、3滴稀醋酸和1滴K3[Fe(CN)6]溶液,可以观察到铁钉表面粘附气泡,同时周围出现蓝色沉淀 | |
| D. | 用量筒量取10.00mL 1.0mol/L的盐酸于100mL溶量瓶中,加水稀释至刻度,可制得0.1mol/L的盐酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
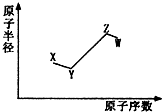 短周期非金属主族元素X、Y、Z、W,它们的原子半径与原子序数的关系如图所示.其中Z元素原子序数是Y的2倍,原子最外层电子数与X元素原子核外电子数相等,下列说法一定正确的是( )
短周期非金属主族元素X、Y、Z、W,它们的原子半径与原子序数的关系如图所示.其中Z元素原子序数是Y的2倍,原子最外层电子数与X元素原子核外电子数相等,下列说法一定正确的是( )| A. | X和Z、Y和W处于同一主族 | |
| B. | 4种元素形成的各种单质中,Z单质的沸点最高 | |
| C. | W单质与X、Y、Z的最简单氢化物都可以发生反应 | |
| D. | 元素氧化物所对应的水化物酸性:W>Z>X |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 按系统命名法,化合物CH3CH(CH3)CH(CH3)CH2CH3名称2,3-二甲基戊烷 | |
| B. | 用新制的Cu(OH)2悬浊液可以鉴别乙酸、乙醇和葡萄糖 | |
| C. | 有机物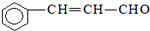 可发生加成反应、氧化反应、还原反应和聚合反应 可发生加成反应、氧化反应、还原反应和聚合反应 | |
| D. | 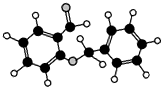 如图所示的有机物分子式为C14H12O2,不能发生银镜反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com