
(本题共12分)氯酸镁[ Mg(ClO3)2 ]常用作催熟剂、除草剂等,实验室制备少量Mg(ClO3)2·6H2O的流程如下:

已知:①卤块主要成分为MgCl2·6H2O,含有MgSO4、FeCl2等杂质。②四种化合物的溶解度(S)随温度(T)变化曲线如图所示。

38.加速卤块在KMnO4溶液中溶解的措施有: (写出一点即可)。
39.加入MgO的作用是 ;过滤后所得滤渣的主要成分为 。
40.加入NaClO3饱和溶液后发生反应的化学方程式为 ,再进一步制Mg(ClO3)2·6H2O晶体的实验步骤依次为:①加热蒸发;② ;③ ;④过滤洗涤。
产品中Mg(ClO3)2·6H2O含量的测定:
步骤1:准确称量3.50 g产品配成100 mL溶液。
步骤2:取10.00 mL试液于锥形瓶中,加入10.00 mL稀硫酸和20 .00mL 1.000 mol/L的FeSO4溶液,微热。
步骤3:冷却至室温,用0.100 mol/L K2Cr2O7 溶液滴定剩余的Fe2+至终点。此过程中反应的离子方程式为:Cr2O72-+6Fe2++14H+→2Cr3++6Fe3++7H2O。
步骤4:将步骤2、3重复两次
41.①写出步骤2中发生反应的离子方程式: ;
②步骤3中若滴定前不用标准液润洗滴定管,将会导致最终结果 (填“偏大”、“偏小”或“不变”);
42.若平均消耗K2Cr2O7 溶液15.00 mL,则产品中Mg(ClO3)2·6H2O的质量分数为 。
38.将卤块粉碎或加热等;(2分)
39.调节溶液的pH,使Fe3+沉淀完全;(1分)BaSO4和Fe(OH)3;(2分)
40.MgCl2+2NaClO3→Mg(ClO3)2+2NaCl↓(1分) 趁热过滤(2分);冷却结晶(1分)
41.①ClO3- +6Fe2++6H+→6Fe3++Cl-+3H2O(1分);②偏小(1分); 42.0.783(1分)
【解析】
试题分析:38、根据外界条件对物质溶解的影响要加速卤块在KMnO4溶液中溶解可以采取的措施为将卤块粉碎或加热等。
39、由于溶液中含有铁离子,需要沉淀除去,因此加入氧化镁的主要是调节溶液的pH,使Fe3+沉淀完全;溶液中的钡离子与硫酸根结合生成硫酸钡沉淀,因此过滤后所得滤渣的主要成分为BaSO4和Fe(OH)3;
40、根据溶解度图像可知氯化钠的溶解度小而氯酸镁的溶解度大,因此加入NaClO3饱和溶液后发生反应的化学方程式为MgCl2+2NaClO3→Mg(ClO3)2+2NaCl↓;由于氯酸镁的溶解度受温度影响最大,所以再进一步制Mg(ClO3)2·6H2O晶体的实验步骤依次为:①加热蒸发;②趁热过滤;③冷却结晶;④过滤洗涤即可。
41、①在酸性条件下氯酸根能氧化亚铁离子,反应的离子方程式为ClO3- +6Fe2++6H+→6Fe3++Cl-+3H2O。
②步骤3中若滴定前不用标准液润洗滴定管,则导致标准液浓度降低,消耗标准液的体积增大,导致剩余的亚铁离子的物质的量增加,因此与氯酸镁反应的亚铁离子减少,从而会导致最终结果偏小。
③消耗K2Cr2O7 的物质的量是0.1mol/L×0.015L=0.0015mol,则根据方程式可知消耗亚铁离子的物质的量是0.0015mol×6=0.009mol。所以与氯酸镁反应的硫酸亚铁是0.02L×1.0mol/L-0.009mol=0.011mol,则根据方程式可知氯酸镁的物质的量是0.011mol/12,所以产品中Mg(ClO3)2·6H2O的质量分数为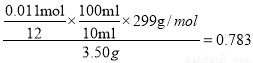 。
。
考点:考查物质制备工艺流程图的分析与应用


科目:高中化学 来源:2014-2015黑龙江省绥化市三校高一上学期期末联考化学试卷(解析版) 题型:选择题
下列实验基本操作(或实验注意事项)中,主要是处于实验安全考虑的是
A.实验剩余的药品不能放回原试剂瓶 B.可燃性气体的验纯
C.气体实验装置在实验前进行气密性检查 D.滴管不能交叉使用
查看答案和解析>>
科目:高中化学 来源:2014-2015学年天津南开区高三上学期第三次月考理综化学试卷(解析版) 题型:选择题
下列实验设计和结论相符的是
A、将碘水倒入分液漏斗,加适量乙醇,振荡后静置,可将碘萃取到乙醇中
B、某气体能使湿润的红色石蕊试纸变蓝,该气体水溶液一定显碱性
C、用Ba(NO3)2溶液鉴别Cl-、SO42-和CO32-
D、用洁净铂丝蘸取溶液进行焰色反应,火焰呈黄色,可知原溶液中有Na+无K+
查看答案和解析>>
科目:高中化学 来源:2014-2015学年四川省达州市普高高三上学期第一次诊断理综化学试卷(解析版) 题型:实验题
(14分)某同学在学习“硫酸及其盐的某些性质与用途”中,进行如下实验探究。
Ⅰ、探究硫酸的性质
(1)某同学设计下图装置(夹持和加热装置略)拟完成有关实验。但该装置在设计上存在明显的安全隐患是

(2)将上述装置改进确认不存在安全隐患并检验气密性后,将铜片放入圆底烧瓶中,通过分液漏斗向圆底烧瓶中滴加足量的浓硫酸,加热圆底烧瓶,充分反应后,观察到圆底烧瓶铜片不断溶解,但有铜片剩余,圆底烧瓶溶液呈蓝色,盛品红溶液的试剂瓶中溶液颜色褪去。回答下列问题:
①圆底烧瓶中发生反应的化学方程式为 。
②装置乙中的试剂是 。
(3)从装置中取下圆底烧瓶,向圆底烧瓶的溶液中持续鼓入空气并加热圆底烧瓶。观察到圆底烧瓶中的红色固体逐渐溶解并完全消失。此时发生反应的离子方程式为
(4)若要用(3)问所得溶液来制备硫酸四氨合铜晶体,其操作是 。
Ⅱ、用KHSO4制取H2O2并测其物质的量浓度。
(1)工业上电解KHSO4饱和溶液制取H2O2的示意图如下(已知:KHSO4=K++H++SO42-):

电解饱和KHSO4溶液时反应的离子方程式 。
(2)测定H2O2的物质的量浓度:
取20.00mL上述已制得的H2O2溶液置于锥形瓶中,加稀硫酸酸化 ②用0.1000mol/LKMnO4溶液滴定 ③用同样方法滴定,三次消耗KMnO4溶液的体积分别为20.00mL、19.98mL、20.02mL,原H2O2溶液中H2O2的物质的量浓度为 。
(已知:滴定时该反应的还原产物是Mn2+,氧化产物是O2)
查看答案和解析>>
科目:高中化学 来源:2014-2015学年四川省达州市普高高三上学期第一次诊断理综化学试卷(解析版) 题型:选择题
下列物质分类正确的是
A.Cl2O和NO2均是酸性氧化物 B.水玻璃和氨水均是混合物
C.烧碱和三氧化硫均为电解质 D.牛奶和氯化铝溶液均为胶体
查看答案和解析>>
科目:高中化学 来源:2014-2015学年上海市闸北区高三上学期期末化学试卷(解析版) 题型:选择题
有人曾建议用AG表示溶液的酸度,AG的定义为:AG=lg ,室温下实验室用0.01 mol/L的氢氧化钠溶液滴定20 mL相同浓度的醋酸溶液,滴定曲线如下图所示。下列有关叙述错误的是
,室温下实验室用0.01 mol/L的氢氧化钠溶液滴定20 mL相同浓度的醋酸溶液,滴定曲线如下图所示。下列有关叙述错误的是

A.A点时加入氢氧化钠溶液体积为20 mL
B.室温时0.01 mol/L的醋酸溶液pH=4
C.OA段溶液中:c(CH3COO-)> c(CH3COOH)
D.若B点时加入NaOH溶液40 mL,所得溶液中:c(CH3COO-)+2 c(CH3COOH) + c(H+) = c(OH-)
查看答案和解析>>
科目:高中化学 来源:2014-2015学年上海市闸北区高三上学期期末化学试卷(解析版) 题型:选择题
除去被提纯物质中的杂质,方案正确的是
编号 | 被提纯的物质 | 杂质 | 除杂试剂 | 除杂方法 |
A. | CO2 (g) | SO2(g) | 饱和Na2CO3溶液、浓H2SO4 | 洗气 |
B. | NaCl(s) | KNO3(s) | AgNO3溶液 | 过滤 |
C. | 苯 | 苯酚 | 浓溴水 | 过滤 |
D. | 苯 | 甲苯 | KMnO4(酸化),NaOH溶液 | 分液 |
查看答案和解析>>
科目:高中化学 来源:2014-2015学年上海市普陀区高三一模化学试卷(解析版) 题型:实验题
(本题共12分)绿矾(FeSO4·7H2O)是治疗缺铁性贫血药品中的重要成分。下面是以市售铁屑(含少量锡、氧化铁等杂质)为原料生产纯净绿矾的一种方法:

已知:室温下饱和H2S溶液的pH约为3.9;SnS沉淀完全时溶液的pH为1.6;FeS开始沉淀时溶液的pH为3.0,沉淀完全时的pH为5.5。
请回答下列问题:
(一)绿矾的制备
38.检验制得的绿矾中是否含有Fe3+的实验操作是 。
39.操作II中,通入硫化氢至饱和的目的是 ;在溶液中用硫酸酸化至pH=2的目的是 。
40.操作IV的顺序依次为: 、冷却结晶、 。
(二)绿矾中FeSO4·7H2O含量的测定
若用容量法测定绿矾中FeSO4·7H2O的含量。滴定反应是:5Fe2+ + MnO4—+8H+?5Fe3+ +Mn2++4H2O 。
实验方案如下:
① 称取15.041 g绿矾产品,溶解,在250mL容量瓶中定容。
② 量取25.00mL待测溶液于锥形瓶中。
③ 用0.0500mol/L KMnO4溶液(硫酸酸化)滴定至终点,记录初读数和末读数。
④ 。
⑤ 数据处理。
41.上述实验方案中的步骤④是 。洁净的滴定管在滴定前必须进行的操作有:
① 检验活塞是否漏水;
② ;
③ 向滴定管中加入KMnO4标准溶液到0刻度以上,赶走尖嘴部位的气泡,调节初读数。
(三)数据处理
某小组同学的实验数据记录如下:
实验次数 | 初读数(mL) | 末读数(mL) |
1 | 0.20 | 21.40 |
2 | 0.00 | 21.00 |
3 | 1.60 | 26.60 |
42.上述样品中FeSO4·7H2O的质量分数为 (用小数表示,保留三位小数)。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年上海市嘉定区高三一模化学试卷(解析版) 题型:选择题
下列实验误差分析错误的是
A.用湿润的pH试纸测稀碱溶液的pH,测定值偏小
B.用容量瓶配制溶液,定容时俯视刻度线,所配溶液浓度偏小
C.滴定前滴定管尖嘴内有气泡,终点读数时尖嘴内无气泡,所测体积偏大
D.测定1mol气体体积时,未冷却至室温就读数,所测体积偏大
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com