
【题目】(1)已知在101 kPa时,32.0 g N2H4(液态)在氧气中完全燃烧生成氮气和H2O,放出热量624 kJ(25 ℃时),N2H4完全燃烧的热化学方程式是__________________。
(2)肼空气燃料电池是一种碱性燃料电池,电解质溶液是20%~30%的KOH溶液。肼空气燃料电池放电时:
正极的电极反应式是______________________________________;
负极的电极反应式是______________________________________。
(3)如图是一个电解过程示意图。

①锌片上发生的电极反应式是_______________________________。
②假设使用肼空气燃料电池作为本过程中的电源,铜片的质量变化为128 g,则肼空气燃料电池理论上消耗标准状况下的空气________L(假设空气中氧气体积分数为20%)。
【答案】 N2H4(l)+O2(g)===N2(g)+2H2O(l) ΔH=-624 kJ·mol-1 O2+2H2O+4e-===4OH- N2H4+4OH--4e-===4H2O+N2↑ Cu2++2e-===Cu 112
【解析】(1)32.0g肼的物质的量为1mol,1molN2H4在氧气中完全燃烧生成氮气放出热量624kJ,所以其热化学反应方程式为:N2H4(l)+O2(g)=N2(g)+2H2O(l)△H=-624KJ/mol,故答案为:N2H4(l)+O2(g)=N2(g)+2H2O(l)△H=-624KJ/mol;
(2)燃料电池中,正极上是氧气发生得电子的还原反应,在碱性环境下,电极反应式为:2H2O+O2+4e-=4OH-,负极上肼失去电子生成氮气,电极反应式为N2H4+4OH--4e-=4H2O+N2↑,故答案为:2H2O+O2+4e-=4OH-;N2H4+4OH--4e-=4H2O+N2↑;
(3)①锌为阴极,发生还原反应生成铜,电极方程式为Cu2++2e-=Cu,故答案为:Cu2++2e-=Cu;
②电解硫酸铜溶液时,铜电极上铜失电子发生氧化反应,当铜片的质量变化128g,失去电子的物质的量=![]() ×2=4mol,1mol氧气生成-2价氧元素得到4mol电子,则需要空气的体积=
×2=4mol,1mol氧气生成-2价氧元素得到4mol电子,则需要空气的体积=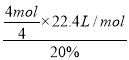 =112L,故答案为:112。
=112L,故答案为:112。


科目:高中化学 来源: 题型:
【题目】向溶液中分别通入足量的相应气体后,下列各组离子还能大量存在的是
A. 氯气:K+、Na+、SiO32-、NO3-
B. 二氧化硫:Na+、NH4+、SO32-、Cl-
C. 硫化氢:H+、K+、MnO4-、SO42-
D. 氨气:K+、Na+、AlO2-、CO32-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是关于反应A2(g)+3B2(g) ![]() 2C(g)(正反应为放热反应)的平衡移动图象,影响平衡移动的原因可能是
2C(g)(正反应为放热反应)的平衡移动图象,影响平衡移动的原因可能是

A. 升高温度,同时加压
B. 降低温度,同时减压
C. 增大反应物浓度,同时使用催化剂
D. 增大反应物浓度,同时减小生成物浓度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】1993年的世界十大科技新闻称中国学者徐志傅和美国科学家穆尔共同合成了世界上最大的碳氢分子,其中一个分子由1134个碳原子和1146个氢原子构成,关于此物质说法错误的是
A. 是烃类化合物 B. 常温下呈固态
C. 分子中可能含不饱和碳原子 D. 不能在空气中燃烧
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究小组对铁生锈进行研究。
(1)甲同学设计了 A、B、C三组实验如图:

探究铁生锈的条件。经过较长时间后,甲同学观察到的现象是: A中铁钉生诱;b中铁钉不生锈;C中铁钉不生锈。
①通过上述实验现象分析,可得出铁生锈的外部条件是______________________________;
②铁钉发生电化学腐蚀的正极电极反应式为______________________________;
③实验B所用的水要经过________处理,植物油的作用是_________________;
④实验C中碱石灰的作用是______________________。
(2)乙同学为了达到同样目的,设计了实验d如图所示:

发现一段时间后,试管中的液面升髙,其原因是____________________________,该实验_______(填“能”或“不能”)说明水对铁钉生锈产生影响。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将煤转化为水煤气是通过化学方法将煤转化为洁净燃料的方法之一。煤转化为水煤气的主要化学反应为:C+H2O![]() CO+H2。 C(s)、CO(g)和H2(g)完全燃烧的热化学方程式分别为:
CO+H2。 C(s)、CO(g)和H2(g)完全燃烧的热化学方程式分别为:
C(s)+O2(g)=CO2(g) △H1=-393.5 kJ·mol-1①
H2(g)+ ![]() O2(g)=H2O(g) △H2=-242.0kJ·mol-1②
O2(g)=H2O(g) △H2=-242.0kJ·mol-1②
CO(g)+ ![]() O2(g)=CO2(g) △H3=-283.0kJ·mol-1③
O2(g)=CO2(g) △H3=-283.0kJ·mol-1③
(1)请你根据以上反应,写出C(s)与水蒸气反应生成CO和H2的热化学方程式:__________________。
(2)比较反应热数据可知,1molCO(g)和1molH2(g)完全燃烧放出的热量之和比1mol C(s)完全燃烧放出的热量________(填“多”或“少”)。
甲同学据此认为:“煤炭燃烧时加少量水,可以使煤炭燃烧放出更多的热量。”乙同学根据盖斯定律作出了下列循环图:

请你写出△H1、△H2、△H3、△H4之间存在的关系式:________________________________。
乙同学据此认为:“将煤转化为水煤气再燃烧放出的热量,最多与直接燃烧煤放出的热量相同。”请分析:甲、乙两同学观点正确的是________(填“甲”或“乙”)同学,另一同学出现错误观点的原因是_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】取碘水四份于试管中,编号为Ⅰ、Ⅱ、Ⅲ、Ⅳ,分别加入直馏汽油、苯、酒精、NaBr溶液,振荡后静置,现象正确的是
A.Ⅰ中溶液分层,下层呈紫红色
B.Ⅱ中溶液分层,上层呈紫红色
C.Ⅲ中溶液分层,下层呈黄褐色
D.Ⅳ中溶液不分层,溶液由黄褐色变成黄绿色
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com