
【题目】将钠、镁、铝各0.3mol分别加入100mL 1mol/L 的盐酸中,在同温同压下产生的气体体积比是( )
A.1:2:3
B.6:3:2
C.3:1:1
D.1:1:1
【答案】C
【解析】解:将三种金属各0.3mol分别投入100mL 1mol/L的盐酸中,可知三种金属都过量,应按盐酸的量计算,镁、铝产生氢气物质的量相等,产生氢气的物质的量为:
(0.1L×1mol/L)× ![]() ═0.05 mol.
═0.05 mol.
但金属钠活泼,能与水反应生成氢气,则生成氢气最多的是钠,
钠与水反应产生氢气应按钠的物质的量计算:0.3mol钠产生0.15mol氢气.
故将钠、镁、铝各0.3mol 分别放入100mL 1mol/L的盐酸中,产生氢气的物质的量之比为:
0.15mol:0.05mol:0.05mol═3:1:1,所以同温同压下产生的气体体积比是3:1:1.
故选C.
根据反应物的量先判断金属与酸哪种过量,按不足量计算.钠与酸反应完会继续与水反应;


 新题型全程检测期末冲刺100分系列答案
新题型全程检测期末冲刺100分系列答案科目:高中化学 来源: 题型:
【题目】过氧化钠在供氧、防腐、除臭、微量分析等多方面有着重要用途,工业生产过氧化钠的方法是先将除去二氧化碳的干燥空气通入熔融的钠(温度453~473K) 中得到氧化钠,然后增加空气流量并迅速升高温度至573~673K 即可得到过氧化钠。某化学兴趣小组在实验室模拟工业流程制备过氧化钠,请回答下列相关问题。
(1)结合下图所示装置写出仪器连接顺序。

空气→______→______→______→______→______。(填导管口序号)_____________
(2)升温后发生的主要反应的化学方程式是_____________。
(3)下列选项中的加热方式适合该实验的是_____________(填选项序号)。
A.电炉 B.水浴 C.酒精喷灯 D.油浴(100-260℃ )
(4)若要提高产品纯度,需在具支试管后添加一个装置,该装置应该是_____________,其作用是_____________。
(5)实验中使用的钠的质量为4.600g,最终所得产品的质量为8.320g,通过仪器检测发现产品中含有少量NaN3,则该实验所得产品的产率为_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】淀粉中加入少量稀硫酸,并加热。为了确定淀粉是否已水解或完全水解,需要①NaOH溶液;②银氨溶液;③新制Cu(OH)2碱性悬浊液;④碘水;⑤BaCl2中的
A.①⑤B.②④C.②③④D.①③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】科学家最近研制出可望成为高效火箭推进剂的N(NO2)3,下列有关N(NO2)3分子的说法正确的是:
A. 该物质是只含共价键的共价化合物 B. 该物质中既含共价键也含离子键
C. 该物质是离子化合物 D. 该物质的组成微粒是阴阳离子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向一定体积的Ba(OH)2溶液中逐滴加入稀硫酸,溶液的导电性(以电流I表示)滴入的稀硫酸的体积(用V表示)间的关系最接近真实情况的是( )
A.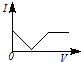
B.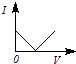
C.
D.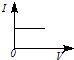
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铝、铍(Be)及其化合物具有相似的化学性质。已知:BeCl2 +Na2BeO2 +2H2O===2NaCl+2Be(OH)2↓能完全进行,则下列推断正确的是 ( )
A. BeCl2水溶液的导电性强,故BeCl2是离子化合物
B. Na2 BeO2溶液的pH>7,将其蒸干并灼烧后得到的残留物为BeO
C. BeCl2溶液的pH<7,将其蒸干并灼烧后得到的残留物可能是BeCl2
D. Be(OH)2既能溶于盐酸,又能溶于NaOH溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于组成生物体的化学元素的叙述,错误的是
A. 在不同的生物体内,组成它们的化学元素的种类大体相同
B. 在同一种生物体内,各种化学元素的含量相同
C. 组成生物体的化学元素依其含量可分为大量元素和微量元素
D. 在组成生物体的大量元素中,碳是组成有机化合物的最基本元素
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.联氨(N2H4,常温下是无色液体)是一种应用广泛的化工原料,可用作火箭燃料,回答下列问题:
(1)已知12.8 g的液态高能燃料联氨在氧气中燃烧,生成气态N2和液态水,放出248.8kJ的热量。写出表示液态联氨燃烧热的热化学方程式___________________。
(2)已知①2O2(g)+N2(g)=N2O4(l) ΔH1
②N2(g)+2H2(g)=N2H4(l) ΔH2
③O2(g)+2H2(g)=2H2O(g) ΔH3
④2 N2H4(l) + N2O4(l)= 3N2(g)+ 4H2O(g) ΔH4=-1048.9kJ/mol
上述反应热效应之间的关系式为ΔH4=___________,联氨和N2O4可作为火箭推进剂的主要原因为_____________。
Ⅱ.现有反应:mA(g)+nB(g)![]() pC(g).达到平衡后,当升高温度时,B的转化率变大;当减小压强时,混合体系中C的质量分数也减小,则:
pC(g).达到平衡后,当升高温度时,B的转化率变大;当减小压强时,混合体系中C的质量分数也减小,则:
(1)该反应的逆反应为_______热反应,且m+n_____p(填“>”“=”“<”)。
(2)若加入B(体积不变),则A的转化率______,B的转化率____(填“增大”“减小”或“不变”)。
(3)若升高温度,则平衡时B、C的浓度之比![]() 将_________。
将_________。
(4)若加入催化剂,平衡时气体混合物的总物质的量_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】要证明某溶液中不含Fe3+而可能含Fe2+,进行如下实验操作时,最佳的顺序是( )
①加足量氯水 ②加足量KMnO4溶液 ③加入少量KSCN溶液
A.①② B.③② C.③① D.①②③
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com