
【题目】三氧化钼(MoO3)是石油工业中常用的催化剂,也是搪瓷釉药的颜料,该物质常使用辉钼矿(主要成分
为MoS2)通过一定条件来制备。回答下列相关问题:
(1)已知:①MoS2(s)Mo(s)+S2(g) △H1;
②S2(g)+2O2(g)2SO2(g) △H2;
③2Mo(s)+3O2(g)2MoO3(s) △H3
则2MoS2(s)+7O2(g)2MoO3(s)+4SO2(g) △H=______(用含△H1、△H2、△H3的代数式表示)。
(2)若在恒温恒容条件下仅发生反应MoS2(s)Mo(s)+S2(g)
①下列说法正确的是______(填字母)。
a.气体的密度不变,则反应一定达到了 平衡状态
b.气体的相对分子质量不变,反应不定处于 平衡状态
c.增加MoS2的量,平衡正向移动
②达到平衡时S2(g)的浓度为1.4 molL-1,充入一定量的S2(g),反应再次达到平衡,S2(g)浓度______(填“>“<“或“=“)1.4 molL-1。
(3)在2L恒容密闭容器中充入1.0 molS2(g)和1.5 mol O2(g),若仅发生反应:S2(g)+2O2(g)2SO2(g),5 min后反应达到平衡,此时容器压强为起始时的80%,则0~5 min内,S2(g)的反应速率为______molL-1min-1。
(4)在恒容密闭容器中,加入足量的MoS2和O2,仅发生反应:2MoS2(s)+7O2(g)2MoO3(s)+4SO2(g) △H.测得氧气的平衡转化率与起始压强、温度的关系如图所示:
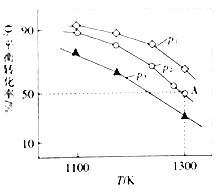
①△H______(填“>“*<“或“=“)0;比较p1、p2、p3的大小:______
②若初始时通入7.0molO2,p2为7.0 kPa,则A点平衡常数Kp=______(用气体平衡分压代替气体平衡浓度计算。分压=总压×气体的物质的量分数,写出计算式即可)。
【答案】2H1+2H2+H3 ab = 0.05 < p1>p2>p3 ![]() (kPa)-3(或
(kPa)-3(或![]() )
)
【解析】
(1)已知:①MoS2(s)Mo(s)+S2(g) △H1;
②S2(g)+2O2(g)2SO2(g) △H2;
③2Mo(s)+3O2(g)2MoO3(s) △H3
利用盖斯定律,将2×①+2×②+③,即可求出MoS2(s)+7O2(g)2MoO3(s)+4SO2(g)。
(2)若在恒温恒容条件下仅发生反应MoS2(s)Mo(s)+S2(g)
①a.平衡移动时,气体的质量改变,密度改变;
b.气体只有S2一种,相对分子质量始终不变;
c.增加MoS2(s)的量,平衡不受影响。
②利用平衡常数进行分析,反应再次达到平衡,S2(g)浓度与1.4 molL-1的关系。
(3)利用三段式,求出S2的物质的量的变化量,从而求出0~5 min内,S2(g)的反应速率。
(4)①采集图象信息,压强不变时,升高温度,O2的平衡转化率减小;温度不变时,O2的平衡转化率由大到小变化时,对应压强顺序为p1、p2、p3。
②若初始时通入7.0molO2,p2为7.0 kPa,图中信息显示,A点时O2的平衡转化率为50%,由此可求出平衡常数Kp。
(1)已知:①MoS2(s)Mo(s)+S2(g) △H1;
②S2(g)+2O2(g)2SO2(g) △H2;
③2Mo(s)+3O2(g)2MoO3(s) △H3
利用盖斯定律,将2×①+2×②+③,即可求出MoS2(s)+7O2(g)2MoO3(s)+4SO2(g) △H=2H1+2H2+H3。答案为:△H=2H1+2H2+H3;
(2)若在恒温恒容条件下仅发生反应MoS2(s)Mo(s)+S2(g)
①a.平衡移动时,气体的质量改变,密度改变,密度不变时,表明反应达平衡状态,a符合题意;
b.气体只有S2一种,相对分子质量始终不变,平衡不一定达平衡状态,b符合题意;
c.增加MoS2(s)的量,平衡不受影响,c不合题意。故选ab。答案为:ab;
②平衡常数K=c(S2),温度不变时,K值不变,c(S2)不变,c(S2)=1.4 molL-1。答案为:=;
(3)设参加反应的S2的物质的量为x
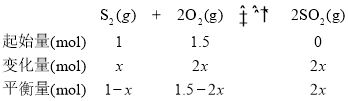
![]() ,x=0.5mol,则0~5 min内,S2(g)的反应速率为
,x=0.5mol,则0~5 min内,S2(g)的反应速率为![]() =0.05molL-1min-1。
=0.05molL-1min-1。
答案为:0.05;
(4)①采集图象信息,压强不变时,升高温度,O2的平衡转化率减小,则平衡逆向移动,△H<0;温度不变时,增大压强,平衡正向移动,O2的平衡转化率增大,图中信息告诉我们,O2的平衡转化率增大,对应压强顺序为p1、p2、p3,由此得出p1>p2>p3。答案为:<;p1>p2>p3;
②三段式为
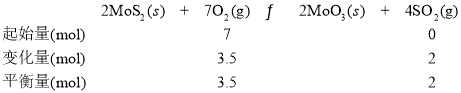
温度、容积不变时,压强之比等于物质的量之比,若初始时通入7.0molO2,压强为7.0 kPa,则达平衡时,压强应为5.5 kPa,平衡常数Kp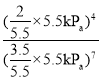 =
=![]() (kPa)-3(或
(kPa)-3(或![]() )。答案为:
)。答案为:![]() (kPa)-3(或
(kPa)-3(或![]() )。
)。


 世纪百通期末金卷系列答案
世纪百通期末金卷系列答案科目:高中化学 来源: 题型:
【题目】根据有机物的命名原则,下列命名正确的是( )
A.CH2Br—CH2Br 二溴乙烷B.CH3CH(C2H5)CH2CH2CH3 2—乙基戊烷
C.CH3OOCCH3 甲酸乙酯D.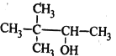 3,3—二甲基—2—丁醇
3,3—二甲基—2—丁醇
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】T℃时,在恒容密闭容器中充入一定量的H2和CO,在催化剂作用下发生如下反应:CO(g)+2H2(g)![]() CH3OH(g)△H<0。反应达到平衡时,CH3OH体积分数与
CH3OH(g)△H<0。反应达到平衡时,CH3OH体积分数与![]() 的关系如图所示。下列说法正确的是
的关系如图所示。下列说法正确的是

A. 反应达平衡时,升高体系温度,CO转化率升高
B. 反应达平衡时,再充入一定量Ar,平衡右移,平衡常数不变
C. 容器内混合气体的密度不再变化说明该反应达到平衡状态
D. ![]() =2.5时达到平衡状态,CH3OH的体积分数可能是图中的F点
=2.5时达到平衡状态,CH3OH的体积分数可能是图中的F点
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向硫酸铜溶液中逐滴滴加浓氨水,先出现现象a,继续滴加浓氨水,现象a逐渐消失,得到一种含二价阳离子的深蓝色透明溶液,继续加入乙醇,析出深蓝色的晶体[Cu(NH3)4]SO4H2O.这种二价阳离子的立体结构如图所示(4个NH3与Cu2+共面,跟H2O-Cu2+-H2O轴线垂直)。请回答以下问题:
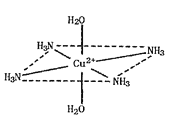
(1)基态Cu原子的价电子轨道表示式__。
(2)硫酸铜水溶液滴加浓氨水的变化过程,现象a是__;写出生成深蓝色透明溶液的离子方程式: __。
(3)NH3与Cu2+可形成[Cu(NH3)4]2+配离子。已知NF3与NH3具有相同的空间构型,但NF3不易与Cu2+形成配离子,其原因是__。
(4)请在二价阳离子的立体结构图中用“→”表示出其中的配位键__。
(5)已知高温下CuO→Cu2O+O2,从铜原子价层电子结构变化角度来看,能生成Cu2O的原因是__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25 ℃时,向NaHCO3溶液中滴入盐酸,混合溶液的pH与离子浓度变化的关系如图所示。下列叙述错误的是

A.25 ℃时,H2CO3的一级电离Ka1(H2CO3)=1.0×10-6.4
B.M点溶液中:c(H+)+ c(H2CO3)=c(Cl-) +2c(CO32-) +c(OH-)
C.25 ℃时,HC![]() +H2O
+H2O![]() H2CO3+OH-的Kh=1.0×10-7.6
H2CO3+OH-的Kh=1.0×10-7.6
D.图中a=2.6
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知常温时CH3COOH的电离平衡常数为K。该温度下向20 mL 0.1 mol·L-1 CH3COOH溶液中逐滴加入0.1 mol·L-1 NaOH溶液,其pH变化曲线如图所示(忽略温度变化)。下列说法中错误的是( )
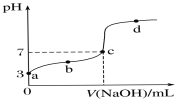
A.a点表示的溶液中c(H+)等于10-3 mol·L-1
B.b点表示的溶液中c(CH3COO-)>c(Na+)
C.c点表示CH3COOH和NaOH恰好反应完全
D.b、d点表示的溶液中![]() 均等于K
均等于K
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图为某漂白剂的结构。已知:W、Y、Z是不同周期、不同主族的短周期元素,W、Y、Z原子最外层电子数之和等于X原子最外层电子数,W、X对应的简单离子核外电子排布相同。下列叙述错误的是( )
![]()
A.W、X对应的简单离子的半径:X>W
B.电解W的氯化物水溶液可以制得W单质
C.实验室可用X和Z形成的某种化合物制取单质X
D.25℃时,Y的最高价氧化物对应水化物的钠盐溶液pH大于7
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质的制备中,不符合工业生产实际的是
A.NH3![]() NO
NO![]() NO2
NO2![]() HNO3
HNO3
B.浓缩海水![]() Br2
Br2![]() HBr
HBr ![]() Br2
Br2
C.饱和食盐水![]() Cl2
Cl2![]() 漂白粉
漂白粉
D.H2和Cl2混合气体![]() HCl气体
HCl气体![]() 盐酸
盐酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用盐酸标准液来滴定NaOH待测液,下列操作可能会使测定结果偏低的是
A. 酸式滴定管只用水洗
B. 锥形瓶只用水洗
C. 使用甲基橙做指示剂
D. 第一次观察酸式滴定管的刻度时仰视
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com