
| A、KOH |
| B、KHSO4 |
| C、HCl |
| D、K2CO3 |


科目:高中化学 来源: 题型:
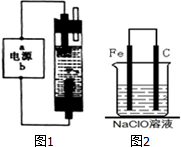 电化学与生产生活密切相关.请运用相关知识回答下列问题:
电化学与生产生活密切相关.请运用相关知识回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
| A、铁制品上电镀锌时,理论上电镀液ZnCl2需要不断更换 |
| B、钢铁设备与外加直流电源的正极相连可以防止钢铁腐蚀 |
| C、甲烷燃料(KOH)电池的正极反应为:O2+2H2O+4e-=4OH- |
| D、粗铜精炼过程中,电路中每通过2mol电子,阳极就会溶解64g铜 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、将58.5 g NaCl溶于1 L水中,所得溶液的物质的量浓度为1 mol/L |
| B、从1 L 2 mol/L的H2SO4溶液中取出0.5 L,所得溶液的浓度为1 mol/L |
| C、配制500 mL 0.5 mol/L的CuSO4溶液,需62.5 g胆矾 |
| D、中和100 g 19.6%的H2SO4溶液,需要NaOH 4 g |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、甲烷的标准燃烧热为-890.3 kJ?mol-1,则甲烷燃烧的热化学方程式可表示为CH4(g)+2O2(g)═CO2(g)+2H2O(g)△H=-890.3 kJ?mol-1 |
| B、500℃、30 MPa下,将0.5 mol N2和1.5 mol H2置于密闭容器中充分反应生成NH3(g),放出的热量为 19.3 kJ,其热化学方程式为N2(g)+3H2(g)?2NH3(g)△H=-38.6kJ?mol-1 |
| C、S(s)+O2(g)═SO2(g)△H=-296.8 kJ?mol-1(反应热) |
| D、2NO2═O2+2NO△H=+116.2 kJ?mol-1(反应热) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、H3PO2中,P元素的化合价为+1价 |
| B、在溶液中Ag+氧化H3PO2为H3PO4时,氧化剂与还原剂的物质的量之比为4:1 |
| C、次磷酸在水中的电离方程式为H3PO2?H++H2PO2- |
| D、NaH2PO2属于酸式盐 |
查看答案和解析>>
科目:高中化学 来源: 题型:
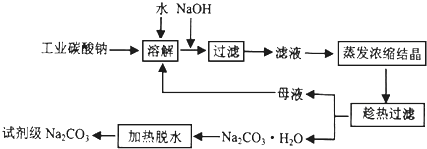
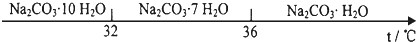
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com