
| A、将58.5 g NaCl溶于1 L水中,所得溶液的物质的量浓度为1 mol/L |
| B、从1 L 2 mol/L的H2SO4溶液中取出0.5 L,所得溶液的浓度为1 mol/L |
| C、配制500 mL 0.5 mol/L的CuSO4溶液,需62.5 g胆矾 |
| D、中和100 g 19.6%的H2SO4溶液,需要NaOH 4 g |
| m |
| M |
| 19.6g |
| 98g/mol |


科目:高中化学 来源: 题型:
| A、苯和环己烷 |
| B、邻氯甲苯和对氯甲苯 |
| C、丙醛(CH3CH2CHO)和丙烯醇(CH2=CHCH2OH) |
| D、苯甲醇和对甲基苯酚 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、NO、NO2是形成酸雨主要原因之一 |
| B、NO能在空气中稳定存在 |
| C、NO能跟血红蛋白作用引起中毒 |
| D、NO也能破坏臭氧层 |
查看答案和解析>>
科目:高中化学 来源: 题型:
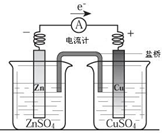
| A、电流方向是从锌片经导线流向铜片 |
| B、锌是阳极,锌片上有大量气泡产生 |
| C、铜离子在铜片表面被氧化,质量逐渐增大 |
| D、盐桥作用主要是离子通道和保持溶液电中性 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①②③ |
| B、②④⑤⑥ |
| C、②③④⑤⑥⑦ |
| D、①②③④⑤⑥⑦ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、C.用0.2000 mol/L NaOH标准溶液滴定HCl与CH3COOH的混合溶液(混合液中两种酸的浓度均约为0.1 mol/L),至中性时,溶液中的酸未被完全中和 |
| B、常温下,反应2A (s)+B (g)=2C (g)+D (g)不能自发进行,则该反应△H一定大于0 |
| C、N2(g)+3H2(g)?2NH3(g)△H<0,其他条件不变时升高温度,反应速率v(H2)和H2的平衡转化率均增大 |
| D、水的离子积常数Kw随着温度的升高而增大,说明水的电离是放热反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
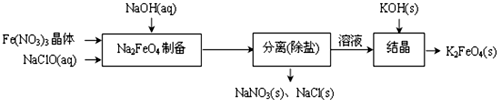
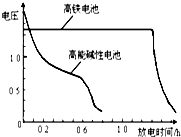
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com