
| A、NO、NO2是形成酸雨主要原因之一 |
| B、NO能在空气中稳定存在 |
| C、NO能跟血红蛋白作用引起中毒 |
| D、NO也能破坏臭氧层 |


科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

| A、滤液A中的阳离子为Fe2+、Fe3+、H+ |
| B、V=224 |
| C、样品中CuO的质量为2.0g |
| D、样品中Fe元素的质量为1.12 g |
查看答案和解析>>
科目:高中化学 来源: 题型:
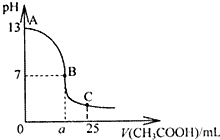 (1)用已知浓度的NaOH溶液测定某H2SO4溶液的浓度.选择
(1)用已知浓度的NaOH溶液测定某H2SO4溶液的浓度.选择查看答案和解析>>
科目:高中化学 来源: 题型:
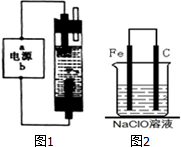 电化学与生产生活密切相关.请运用相关知识回答下列问题:
电化学与生产生活密切相关.请运用相关知识回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
| A、X的能量一定高于M |
| B、因该反应为放热反应,故不必加热就可发生 |
| C、Y的能量一定高于N |
| D、X和Y的总能量一定高于M和N的总能量 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、铁制品上电镀锌时,理论上电镀液ZnCl2需要不断更换 |
| B、钢铁设备与外加直流电源的正极相连可以防止钢铁腐蚀 |
| C、甲烷燃料(KOH)电池的正极反应为:O2+2H2O+4e-=4OH- |
| D、粗铜精炼过程中,电路中每通过2mol电子,阳极就会溶解64g铜 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、将58.5 g NaCl溶于1 L水中,所得溶液的物质的量浓度为1 mol/L |
| B、从1 L 2 mol/L的H2SO4溶液中取出0.5 L,所得溶液的浓度为1 mol/L |
| C、配制500 mL 0.5 mol/L的CuSO4溶液,需62.5 g胆矾 |
| D、中和100 g 19.6%的H2SO4溶液,需要NaOH 4 g |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、铜与硝酸银溶液反应:Cu+Ag+=Cu2++Ag |
| B、氯气溶于水:Cl2+H2O?H++Cl-+HClO |
| C、硫酸溶液中滴加氢氧化钡溶液:H++SO42-+Ba2++OH-=H2O+BaSO4↓ |
| D、氯化钙溶液中通入二氧化碳气体:Ca2++CO2+H2O=CaCO3↓+2H+ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com