


 期末100分闯关海淀考王系列答案
期末100分闯关海淀考王系列答案 小学能力测试卷系列答案
小学能力测试卷系列答案科目:高中化学 来源: 题型:
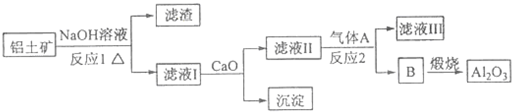
查看答案和解析>>
科目:高中化学 来源: 题型:
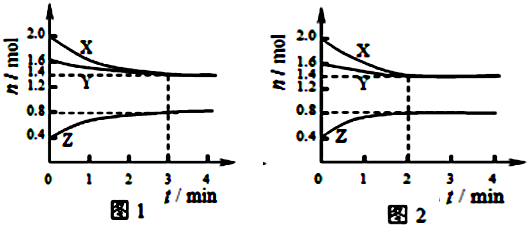
| A、容器中发生的反应可表示为:3X(g)+Y(g)?2Z(g) |
| B、反应进行前3min内,用X表示的反应速率v(X)=0.1mol/(L?min) |
| C、若改变反应条件,使反应进程如图2所示,则改变的条件是增大压强 |
| D、如图1所示,该反应达到化学平衡时,X的转化率为70% |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、电解后溶液的pH都增大 |
| B、在两个阳极上得到的产物的物质的量不相等 |
| C、硝酸亚汞的分子式为Hg2(NO3)2 |
| D、在两个阴极上得到的银和汞的物质的量之比为2:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、区分晶体和非晶体最可靠的科学方法是对固体进行X-射线衍射实验 |
| B、晶体与非晶体的本质区别在于是否具有规则的几何外形 |
| C、分子晶体熔化时,不破坏共价键;原子晶体熔化时,破坏共价键 |
| D、在金属铜的晶体中,由于存在自由电子,因此铜能导电 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、CH4>SiH4>GeH4>SnH4 |
| B、KCl>NaCl>NaF>LiF |
| C、Rb>K>Na>Li |
| D、金刚石>氯化钠>钠>干冰 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、苯和环己烷 |
| B、邻氯甲苯和对氯甲苯 |
| C、丙醛(CH3CH2CHO)和丙烯醇(CH2=CHCH2OH) |
| D、苯甲醇和对甲基苯酚 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、NO、NO2是形成酸雨主要原因之一 |
| B、NO能在空气中稳定存在 |
| C、NO能跟血红蛋白作用引起中毒 |
| D、NO也能破坏臭氧层 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com