
| A、电解后溶液的pH都增大 |
| B、在两个阳极上得到的产物的物质的量不相等 |
| C、硝酸亚汞的分子式为Hg2(NO3)2 |
| D、在两个阴极上得到的银和汞的物质的量之比为2:1 |


科目:高中化学 来源: 题型:
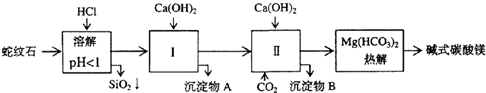
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| 物质 | 杂质 | 除杂所用试剂和方法 | |
| A | CO2 | CO | 在氧气中点燃 |
| B | NaCl固体 | 泥沙 | 加水溶解、过滤、蒸发结晶 |
| C | Cu | Fe | 加稀盐酸溶解、过滤 |
| D | KCl | I2 | 加热 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、A的转化率变大 |
| B、平衡向正反应方向移动 |
| C、D的质量分数变大 |
| D、a<c+d |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、任何晶体中,若含有阳离子也一定含有阴离子 |
| B、金属键越强,则该金属的金属性越强 |
| C、金属钨的熔点高于金属钠,是因为钨的金属键更强 |
| D、金属导电的过程实质上就是金属键被破坏的过程,不能用“电子气理论”来解释 |
查看答案和解析>>
科目:高中化学 来源: 题型:
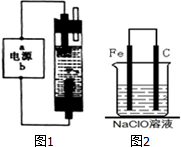 电化学与生产生活密切相关.请运用相关知识回答下列问题:
电化学与生产生活密切相关.请运用相关知识回答下列问题:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com