
| A、A的转化率变大 |
| B、平衡向正反应方向移动 |
| C、D的质量分数变大 |
| D、a<c+d |


科目:高中化学 来源: 题型:
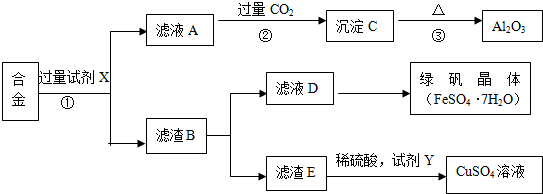
查看答案和解析>>
科目:高中化学 来源: 题型:
| 化学式 | 开始沉 淀时的 pH值 | 沉淀完 全时的 pH值 |
| Mn(OH)2 | 8.8 | 10.4 |
| Fe(OH)2 | 7.6 | 9.6 |
| Fe (OH)3 | 2.7 | 3.7 |
| Zn(OH)2 | 6.4 | 7.8 |
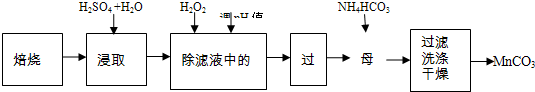
查看答案和解析>>
科目:高中化学 来源: 题型:

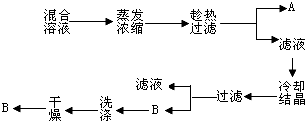
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、电解后溶液的pH都增大 |
| B、在两个阳极上得到的产物的物质的量不相等 |
| C、硝酸亚汞的分子式为Hg2(NO3)2 |
| D、在两个阴极上得到的银和汞的物质的量之比为2:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
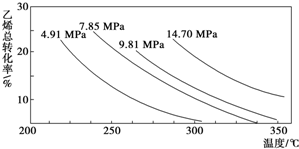 工业上采用乙烯和水蒸气在催化剂(磷酸/硅藻土)表面合成乙醇,反应原理为CH2═CH2(g)+H2O(g)?CH3CH2OH(g),副产物有乙醛、乙醚及乙烯的聚合物等.如图是乙烯的总转化率随温度、压强的变化关系,下列说法正确的是( )
工业上采用乙烯和水蒸气在催化剂(磷酸/硅藻土)表面合成乙醇,反应原理为CH2═CH2(g)+H2O(g)?CH3CH2OH(g),副产物有乙醛、乙醚及乙烯的聚合物等.如图是乙烯的总转化率随温度、压强的变化关系,下列说法正确的是( )| A、合成乙醇的反应一定为放热反应 |
| B、目前工业上采用250~300℃,主要是因为在此温度下乙烯的转化率最大 |
| C、目前工业上采用加压条件(7 MPa左右),目的是提高乙醇的产率和加快反应速率 |
| D、相同催化剂下,在300℃14.70 MPa乙醇产率反而比300℃7.85 MPa低得多,是因为加压平衡向逆反应方向移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 溶解 |
| ① |
| ② |
| ③ |
| Na2CO3 |
| ④ |
| 过滤 |
| ⑤ |
| 适量盐酸 |
| ⑥ |
| 蒸发、结晶、烘干 |
| ⑦ |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com