
| A、硫酸铜溶液 |
| B、氯化铁溶液 |
| C、氢氧化铁胶体 |
| D、氯化钠溶液 |


 开心试卷期末冲刺100分系列答案
开心试卷期末冲刺100分系列答案 双基同步导航训练系列答案
双基同步导航训练系列答案 黄冈小状元同步计算天天练系列答案
黄冈小状元同步计算天天练系列答案科目:高中化学 来源: 题型:
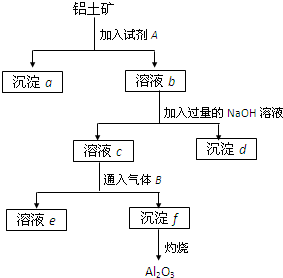 铝土矿的主要成分是Al2O3,含有Fe2O3、SiO2等杂质,按下列操作从铝土矿中提取Al2O3.回答下列问题:
铝土矿的主要成分是Al2O3,含有Fe2O3、SiO2等杂质,按下列操作从铝土矿中提取Al2O3.回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1mol |
| B、0.5mol |
| C、0.125mol |
| D、0.25mol |
查看答案和解析>>
科目:高中化学 来源: 题型:
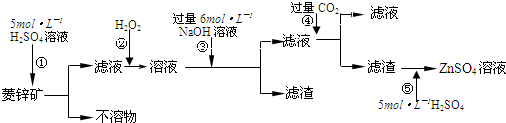
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
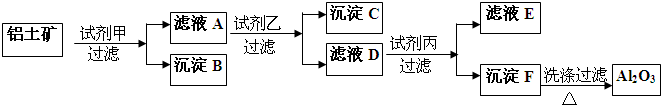
查看答案和解析>>
科目:高中化学 来源: 题型:
| 物质 | 杂质 | 除杂所用试剂和方法 | |
| A | CO2 | CO | 在氧气中点燃 |
| B | NaCl固体 | 泥沙 | 加水溶解、过滤、蒸发结晶 |
| C | Cu | Fe | 加稀盐酸溶解、过滤 |
| D | KCl | I2 | 加热 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

| A、滤液A中的阳离子为Fe2+、Fe3+、H+ |
| B、V=224 |
| C、样品中CuO的质量为2.0g |
| D、样品中Fe元素的质量为1.12 g |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com