


科目:高中化学 来源: 题型:
| 物质 | 丙酮 | 乙酸乙酯 | 乙醇 | 乙酸 |
| 沸点(℃) | 56.2 | 77.06 | 78 | 117.9 |
查看答案和解析>>
科目:高中化学 来源: 题型:

| A、图1配制250 mL 0.10 mol?L-1盐酸 |
| B、图2稀释浓硫酸 |
| C、图3称量氯化钠固体 |
| D、图4检验铁粉与水蒸气反应产生的氢气 |
查看答案和解析>>
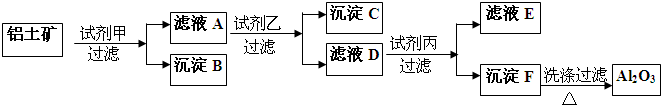
科目:高中化学 来源: 题型:
| 阳离子 | Fe3+ | Fe2+ | Mg2+ | Al3+ | Cu2+ | Cr3+ |
| 开始沉淀时的pH | 1.9 | 7.0 | - | - | 4.7 | - |
| 沉淀完全时的pH | 3.2 | 9.0 | 11.1 | 8 | 6.7 | 9(>9溶解) |
查看答案和解析>>
科目:高中化学 来源: 题型:
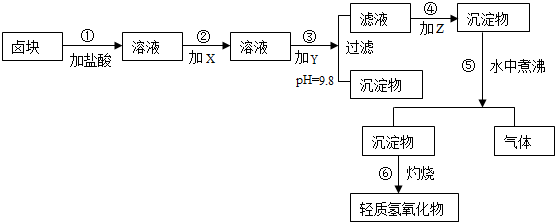
| 物质 | 开始沉淀 | 沉淀完全 | 试剂 | 价格(元/吨) | |
| Fe(OH)3 | 2.7 | 3.7 | 漂液(含NaClO25.2%) | 450 | |
| Fe(OH)2 | 7.6 | 9.6 | H2O2(30%) | 2400 | |
| Mn(OH)2 | 8.3 | 9.8 | NaOH(固98%) | 2100 | |
| Mg(OH)2 | 9.6 | 11.1 | Na2CO3(固95%) | 600 | |
| 卤块(MgCl2,30%) | 310 |
查看答案和解析>>
科目:高中化学 来源: 题型:
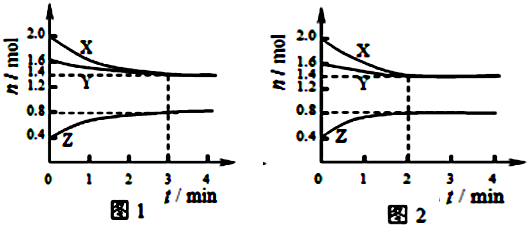
| A、容器中发生的反应可表示为:3X(g)+Y(g)?2Z(g) |
| B、反应进行前3min内,用X表示的反应速率v(X)=0.1mol/(L?min) |
| C、若改变反应条件,使反应进程如图2所示,则改变的条件是增大压强 |
| D、如图1所示,该反应达到化学平衡时,X的转化率为70% |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、区分晶体和非晶体最可靠的科学方法是对固体进行X-射线衍射实验 |
| B、晶体与非晶体的本质区别在于是否具有规则的几何外形 |
| C、分子晶体熔化时,不破坏共价键;原子晶体熔化时,破坏共价键 |
| D、在金属铜的晶体中,由于存在自由电子,因此铜能导电 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、所有金属元素都可以用焰色反应来确定其存在 |
| B、三位美国科学家因给复杂化学体系设计多尺度模型面共享了2013年诺贝尔化学奖 |
| C、已知PM2.5是指大气中直径≤2.5微米的颗粒物,对人体健康危害很大 |
| D、借助仪器来分析化学物质的组成是常用的手段,原子吸收光谱常用来确定物质中含有哪些金属元素 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com